
ISO13485 และ MDSAP -Medical Device Single Audit Program
MDSAP – Medical Device Single Audit program คือ โปรแกรมการตรวจรับรองระบบบริหารคุณภาพเครื่องมือแพทย์ในครั้งเดียว โดยความร่วมมือกัน 5 ประเทศ International consortium of countries ซึ่งได้แก่ ประเทศออสเตรเลีย ประเทศบราซิล ประเทศแคนาดา ประเทศญี่ปุ่น และสหรัฐอเมริกา
โดยปกติแล้วผู้ผลิตเครื่องมือแพทย์จะคุ้นเคยและมีเป้าหมายการประยุกต์ใช้ระบบบริหารคุณภาพสำหรับเครื่องมือแพทย์ คือ ISO 13485 แต่สำหรับผู้ส่งออกผลิตภัณฑ์เครื่องมือแพทย์เข้าสู่ 5 ประเทศ คือ ออสเตรเรีย บราซิล แคนาดา สหรัฐอเมริกา และประเทศญี่ปุ่น ต้องประยุกต์ใช้และขอการรับรอง MDSAP หรือ Medical Device Single Audit Program โดยมีมาตรฐาน ISO13485 เป็นพื้นฐาน มีข้อกำหนดหลักของระบบและควบรวมหรือบูรณาด้วย กฎหมายและกฎระเบียบของแต่ละประเทศ ดังนั้น MDSAP จึงเป็นแนวทางที่ผู้ผลิตและส่งออก สามารถตรวจและขอการรับรองมาตรฐานคุณภาพในครั้งเดียว จากหน่วยงานตรวจรับรองที่ได้รับมอบหมายหรืออนุมัติ AOs (Auditing Organizations)
ภาพแสดงหน่วยงานตรวจรับรอง AO-Auditing Organizations
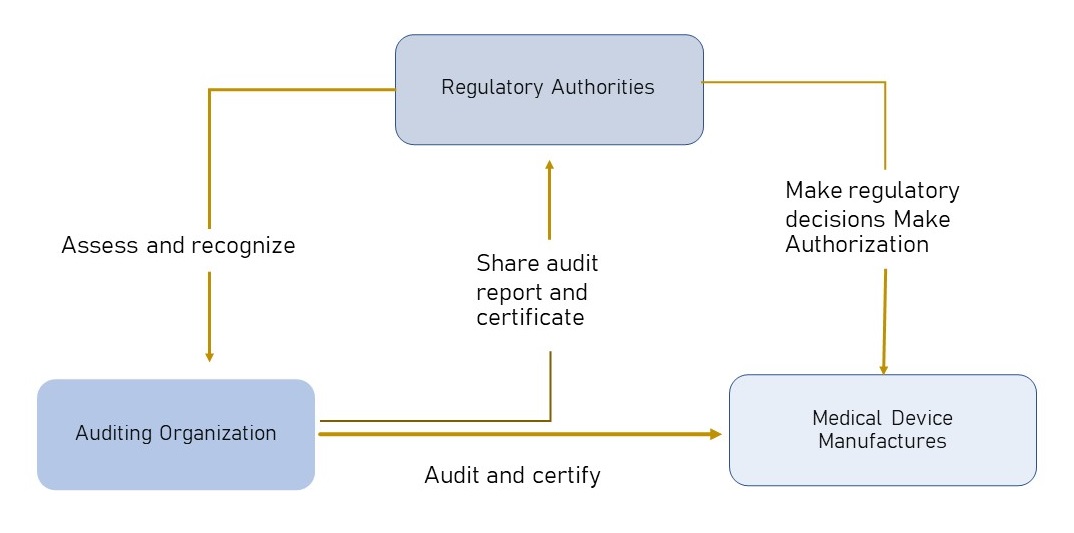
Refer:MDSAP
MDSAP มีเป้าหมาย คือปฏิบัติใช้ระบบและข้อกำหนดที่กำหนดใน IMDRF MDSAP model การประยุกต์ใช้ระบบ ควบรวมกับกฎหมาย กฎระเบียบข้อบังคับของหน่วยงานกำกับดูแลอย่างมีประสิทธิภาพ ในขณะเดียวกันสามารถที่จะลดความซ้ำซ้อนและภาระด้านกฎระเบียบเฉพาะของเครื่องมือแพทย์ MDSAP ต้องการส่งเสริมให้เกิดความสม่ำเสมอ ความสามารถการคาดการณ์และความโปร่งใสของหน่วยงานกำกับดูแลโดยผ่านมาตรฐาน
ISO13485 และ MDSAP ข้อกำหนด
MDSAP เป็น 7 Chapters โดยในที่นี้ขอเปรียบเทียบกับข้อกำหนดของ ISO 13485 คือ
Chapter 1:Process Management การจัดการกระบวนการ
เปรียบเทียบกับ ข้อกำหนดที่ 4 และข้อกำหนดที่ 5 ของ ISO13485 โดยการจัดทำแผนงานสำหรับระบบบริหารคุณภาพ ครอบคลุมการกำหนดนโยบาย วัตถุประสงค์ การจัดทำเอกสาร และการวางแผนบริหารความเสี่ยง รวมถึงการกำหนดทักษะความสามารถบุคลากร

Chapter 2 : Process : Device Marketing Authorization and Facility Registration
กระบวนการ : การขออนุญาตทำการตลาดเครื่องมือแพทย์ และการขึ้นทะเบียนสถานประกอบการ

Chapter 3: Measurement, Analysis and Improvement (MAI)
กระบวนการ : การตรวจวัด, วิเคราะห์ และการปรับปรุง (MAI)

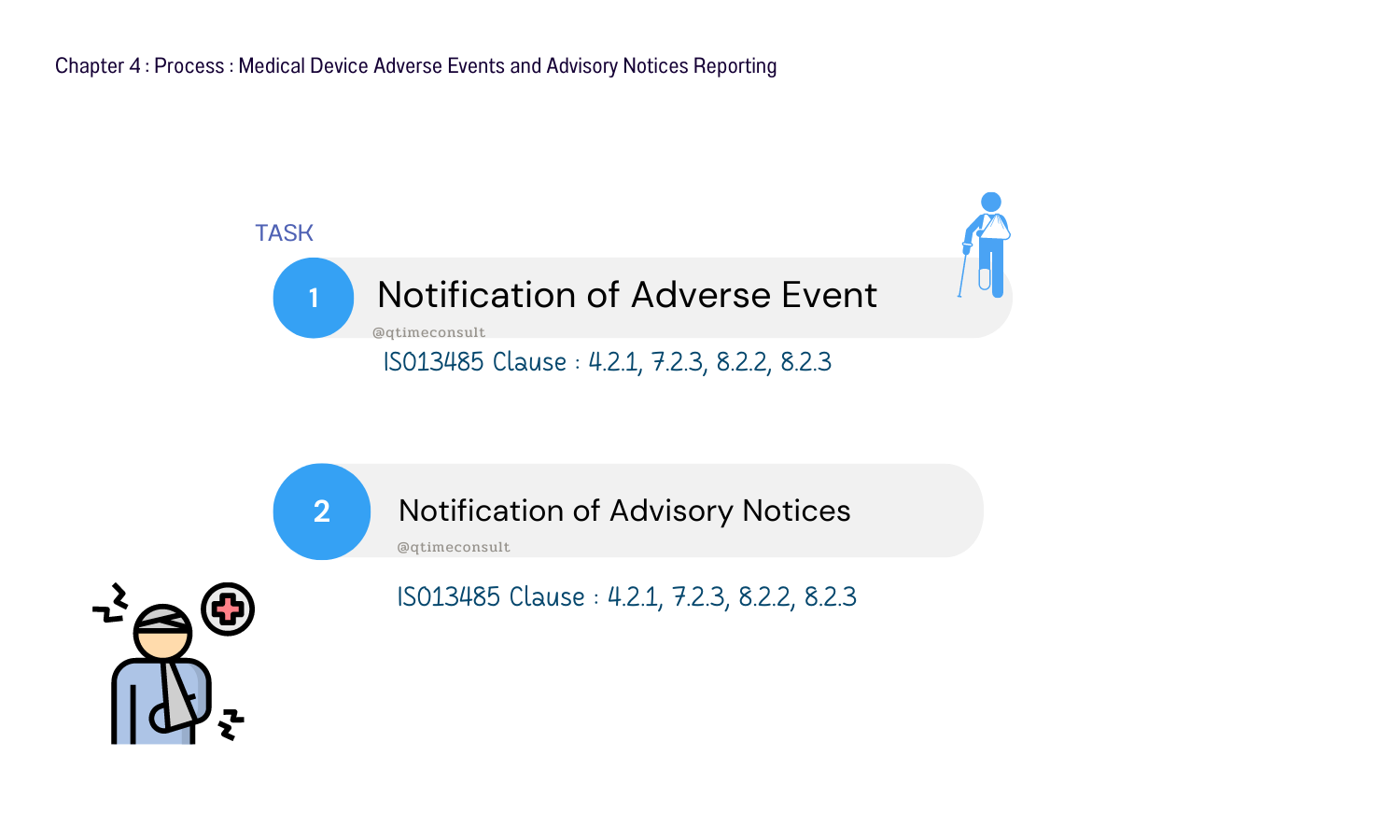
Chapter 4 : Process : Medical Device Adverse Events and Advisory Notices Reporting
การรายงานเหตุการณ์ไม่พึงประสงค์ และการประกาศแนะนำ
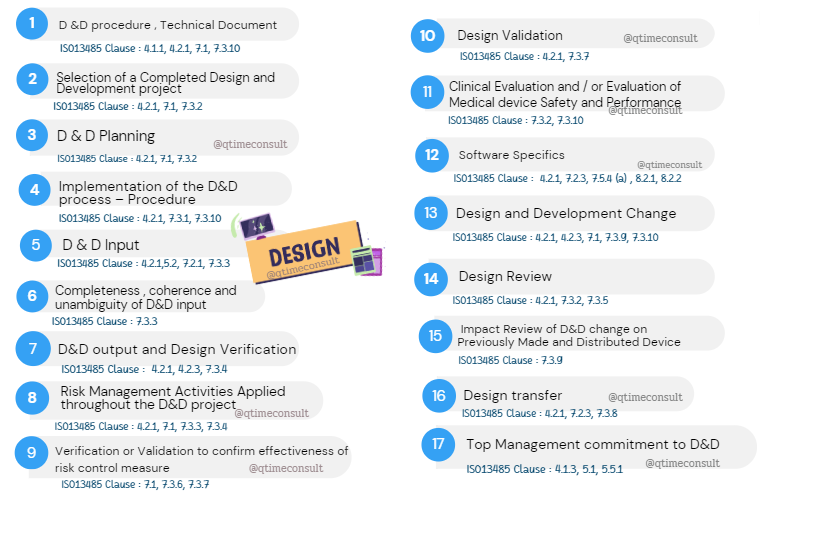
Chapter 5 : Process : Design and Development
กระบวนการ : การออกแบบและพัฒนา (ข้อกำหนดที่ 7.3, ISO13485)
Chapter 6:Production and Service Controls
การควบคุมการผลิตและการบริการ


Chapter 7 : Purchasing การจัดซื้อ
การประยุกต์ใช้ ISO13485 และ MDSAP
การประยุกต์ใช้ MDSAP และระบบบริหารคุณภาพสำหรับผลิตภัณฑ์เครื่องมือแพทย์ หรือ ISO13485 ในรูปแบบบูรณาการณ์ระบบ โดยผู้ผลิตต้องนำ กฎระเบียบข้อบังคับจากหน่วยกำกับดูแล โดยเฉพาะกฎระเบียบข้อบังคับประเทศที่ต้องการขออนุญาตวางตลาด มาพิจารณาและปฏิบัติใช้ด้วย
- Scoping กำหนดขอบเขตผลิตภัณฑ์ กิจกรรมที่ต้องการประยุกต์ใช้และขอการรับรอง MDSAP ให้ชัดเจน รวมถึงประเทศหรือหน่วยงานกำกับดูแลที่ต้องนำผลิตภัณฑ์เข้าสู่ตลาดทั้งนี้เพื่อวางแผนการนำกฎระเบียบและข้อบังคับของประเทศนั้นๆ มาปฏิบัติ
- Regulations and Standards ข้อกำหนดและมาตรฐานที่เกี่ยวข้อง ทีมผู้รับผิดชอบควรต้องศึกษา และสำรวจข้อกำหนดในแต่ละประเทศให้ชัดเจน เช่น ข้อกำหนดในการขึ้นทะเบียนสถานประกอบการ
- Planning จัดทำแผนการดำเนินการ และทีมผู้รับผิดชอบ
- Training จัดการอบรมข้อกำหนดและการประยุกต์ใช้ MDSAP และศึกษาข้อกำหนดกฎหมายและกฎระเบียบของประเทศที่เกี่ยวข้อง
- Applicable and N/A ทบทวนข้อกำหนดที่ต้องประยุกต์ใช้และไม่ประยุกต์ใช้ รวมถึงการประเมิน Gap Analysis หรือศึกษาความแตกต่างในแต่ละข้อกำหนด
- SoPs การจัดทำระเบียบปฏิบัติ แบบฟอร์มการบันทึก คู่มือปฏิบัติงาน สอดคล้องตามข้อกำหนดและกฎหมาย
- Records / Implementation จัดทำบันทึกและการปฏิบัติใช้
- Measurement / Monitoring ตรวจวัดติดตามผลการปฏิบัติงาน แต่ละหน่วยงานที่เกี่ยวข้อง
- Internal audit การตรวจติดตามระบบภายใน
- Corrective action การปฏิบัติการแก้ไขและป้องกัน
- Improvement การวางแผนปรับปรุงอย่างต่อเนื่อง
บทความที่เกี่ยวข้อง
แหล่งที่มาข้อมูล
MDSAP-Medical Device Single Audit Program
ISO13485:2016 Medical Device- Quality Management System -Requirements for regulatory purposes

