
Process Validation
การตรวจรับรองความถูกต้องของกระบวนการ
Process Validation คือการตรวจรับรองหรือการทวนสอบความถูกต้องของกระบวนการผลิต สำหรับระบบบริหารคุณภาพ ISO13485 การผลิตหรือการบริการเครื่องมือแพทย์ ให้ความสำคัญการ Validation ไว้ในหลากหลายกระบวนการที่ สำคัญ ๆ เช่น
- Design Validation
- Software Validation
- Cleanroom Validation
- Sterilization Validation
- Reprocessing Validation
- Cleaning Validation
แต่ในบทความนี้ ขอเสนอการตรวจรับรองกระบวนการ ตามข้อกำหนด 7.5.6, ISO 13485 โดยอ้างอิงตาม G FDA 21 CFR 820.75 Process validation และ GHTF/SG3/N99-10:2004
Process validation เป็นวิธีการหนึ่งที่ยืนยันความถูกต้องและประสิทธิภาพ ตั้งแต่ในกระบวนการ เพื่อลดความเสี่ยงในกระบวนการที่อาจมีการเปลี่ยนเปลงหรือมีผลกระทบต่อคุณภาพของสินค้า รวมถึงการลดความสูญเสียในด้านต่างๆ เช่น ค่าใช้จ่ายในการตรวจสอบโดย QC / Inspection ผลิตภัณฑ์ การประหยัดเวลา และสามารถนำพัฒนาทักษะความรู้ใหม่ๆ ด้านอื่นๆ ให้กับพนักงาน
กระบวนการใดบ้างต้องทำ Validation
ก่อนจะเริ่มทำ Validation ที่ปรึกษาแนะนำให้ตอบคำถามโดยใช้แผนภูมิต้นไม้ หรือ Decision Tree การวิเคราะห์ พิจารณาก่อน
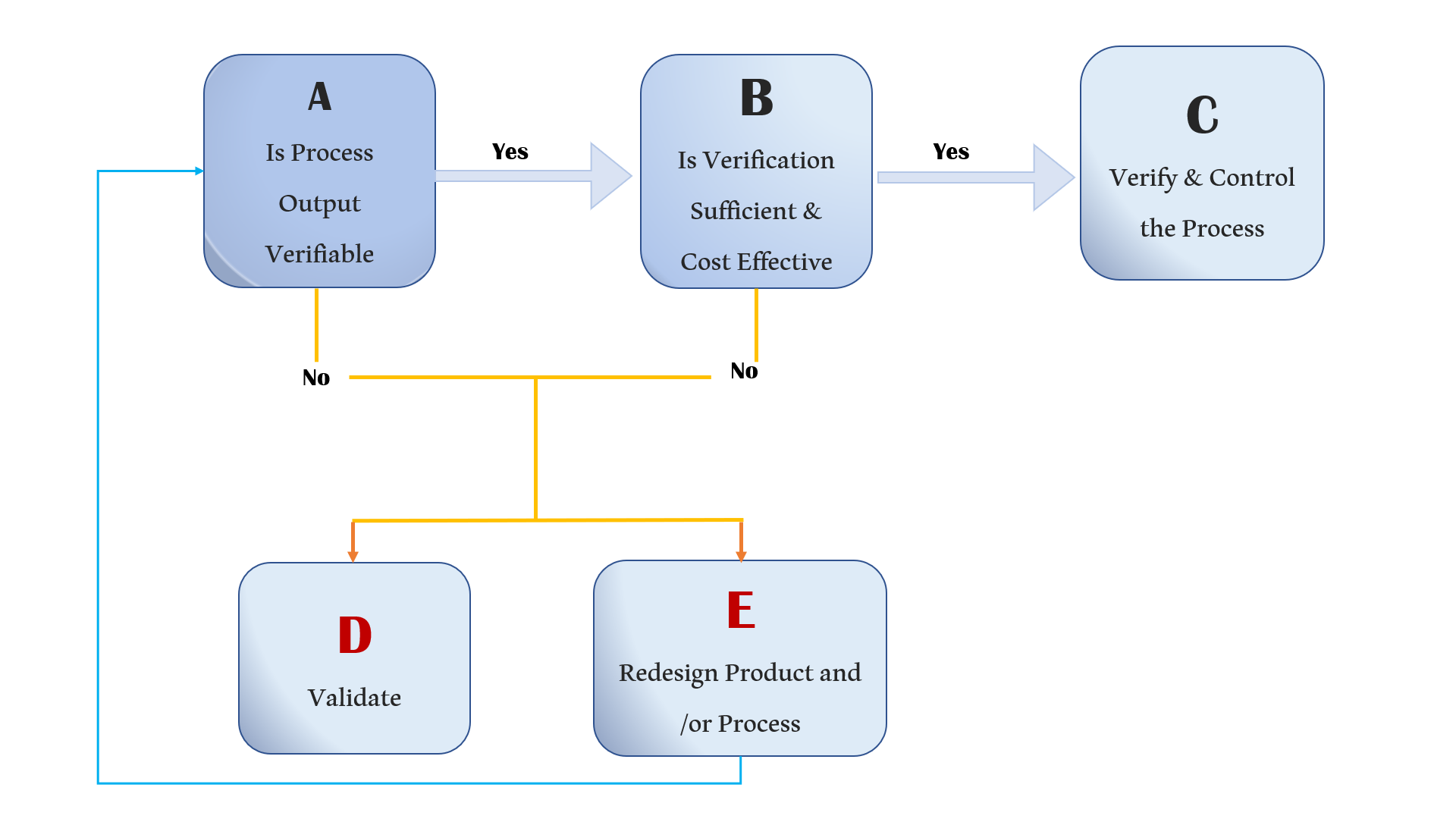
- ขั้นตอน A พิจารณาว่ากระบวนการนั้นสามารถตรวจสอบ ตรวจเช็ค ได้หรือไม่
- ขั้นตอน B จาก A หากตรวจสอบได้ B การตรวจสอบนั้นเพียงพอหรือไม่ และส่งผลกระทบต่อต้นทุน ค่าใช้จ่าย พนักงาน ผู้ปฏิบัติงาน รวมไปถึงทักษะความสามารถในการตรวจสอบประมาณใด
- ถ้าคำตอบเป็นไปในทางที่พึงพอใจ สามารถปฏิบัติได้ กระบวนการนั้นก็สามารถใช้วิธีการตรวจสอบและควบคุมได้ต่อไป
- ถ้าคำตอบไม่พึงพอใจ เช่นมีต้นทุนการตรวจสอบ การตรวจสอบ แล้วต้องทิ้งตัวอย่าง ควรนำมาจัดทำการ Validation หรือหากไม่สามารถทำได้ ต้องพิจารณาการออกแบบและพัฒนาผลิตภัณฑ์หรือกระบวนการใหม่
- เข้าสู่ขั้นตอนการจัดทำ Process Validation
ขั้นตอนเริ่มต้น คือการจัดตั้งทีม ผู้รับผิดชอบ การตรวจเช็คความพร้อมของอุปกรณ์เครื่องมือที่เกี่ยวข้อง ช่วงระยะเวลาการเก็บข้อมูล การกำหนดเทคนิคและ Tools ที่จะนำมาใช้ประกอบการ Validation ในแต่ละกระบวนการ
การใช้เชิงสถิติในการเก็บและวิเคราะห์ข้อมูล Process Validation โดยในแต่ละกระบวนการ ควรต้องเลือกเครื่องมือเชิงสถิติที่เหมาะสม เช่น
- Taguchi Method วิธีการทางสถิติ
- FMEA : Failure Modes and Effects Analysis
- Tolerance Analysis การวิเคราะห์ค่าความเผื่อหรือการเบี่ยงเบน
- AQL for Sampling plans and method
- Control Charts
3Q ในการจัดทำ Process validation
- IQ-Installation Qualification คุณลักษณะของอุปกรณ์เครื่องมือสำหรับการผลิตและการบริการ การรวบรวมข้อมูลของเครื่องจักร อุปกรณ์เครื่องใช้ที่ใช้ในการผลิตกระบวนการนที่ต้อง Validation, ระบุฟังก์ชั่น, คุณลักษณะ คุณสมบัติ เงื่อนไขการติดตั้ง การสอบเทียบ
- OQ- Operational Qualification การกำหนดการตรวจสอบและตรวจวัด ต้องระบุอะไรบ้างที่ต้องตรวจสอบอย่างไร ระบุพารามิเตอร์ที่มีนัยสำคัญ เมื่อไหร่ และระบุเกณฑ์การยอมรับ รวมถึง ค่าแรงดัน อุณหภูมิ เวลา และอื่นๆ
- Change Controls การควบคุมการเปลี่ยนแปลง เช่น วัตถุดิบถูกเปลี่ยน การออกแบบเปลี่ยน
- PQ-Performance Qualification การจัดทำ กำหนดค่าพารามิเตอร์แต่ละกระบวนการเพื่อเข้าสู่การผลิตอย่างถูกต้อง ลดความผิดพลาด
บทความสั้น Process Validation
เอกสารที่จัดทำใน Process Validation
- SOP -Procedure ขั้นตอนการปฏิบัติงานครอบคลุมขั้นตอนตั้งแต่เริ่มต้นของกระบวนการ Validation การติดตามและควบคุม การ PQ-Performance Qualification และการวางตรวจรับรองใหม่ (Re-validation)
- จัดทำแผนการตรวจรับรองความถูกต้องของกระบวนการ
- จัดทำรายงานผลการจัดทำ Process validation ของแต่ละกระบวนการ Report of Validation
การบริการของ Q Time
- Training การอบรมเชิงปฏิบัติ “Process Validation” โดยเนื้อหาอบรมเน้นที่การทวนสอบในกระบวนการ รวมถึงอุปกรณ์ เครื่องจักร (สำหรับเครื่องจักร อุปกรณ์ใหม่) แนะนำและ workshop การเขียนขั้นตอนปฏิบัติ (SOP) การเขียนแผน IQ OQ PQ
- Consulting : การให้คำปรึกษา แนะนำ วิเคราะห์ การเลือกใช้ เทคนิคและ Tools ที่เหมาะสมของแต่ละกระบวนการ เพื่อให้ได้ประสิทธิภาพและประสิทธิผลของการตรวจความถูกต้องของกระบวนการ
แหล่งข้อมูลอ้างอิง
- FDA Validation Requirements for Medical Devices
- GHTF/SG3/N99-10:2004 (Edition 2)
- Process Validation and Revalidation in Medical Device Production., ScienceDirect A. Procedia Engineering 174 ( 2017 ) 686 – 692.

