
ISO14971 Risk Management for Medical Device
การบริหารความเสี่ยงสำหรับเครื่องมือแพทย์
ISO14971 Risk Management แนวทางการวิเคราะห์ การประเมิน ควบคุม และการบริหารความเสี่ยงอย่างเป็นระบบ ทั้งนี้เพื่อลดความเสี่ยงและอันตราย จากเครื่องมือแพทย์ที่อาจจะเกิดกับผู้ป่วยและผู้ใช้
ความสำคัญของ ISO14971
Risk Management หรือการบริหารความเสี่ยง ในปัจจุบันมีความสำคัญมากขึ้น ไม่ใช่เป็นเพียง Guidelines ที่อยู่ในข้อกำหนดมาตรฐาน ISO13485 เท่านั้น ยังกลายเป็นกฎหมาย กฎระเบียบข้อบังคับ ของหน่วยงานกำกับดู (Regulator) ของแต่ละประเทศด้วย เช่น CE Marking for Medical Device , IVDR, USFDA กำหนดให้ต้องบริหารความเสี่ยงของเครื่องมือแพทย์ที่จะนำไปวางจำหน่าย อย่างเป็นระบบและต่อเนื่อง
ผู้ผลิตชิ้นส่วน หรืออยู่ในห่วงโซ่ของเครื่องมือแพทย์ ก็สามารถนำ ISO14971 มาประเมินความเสี่ยงด้วยเช่นเดียวกัน
ข้อกำหนด ISO13485 ที่กำหนดเรื่องความเสี่ยง
นอกจาก ISO13485 แล้ว ยังมีมาตรฐานผลิตภัณฑ์เครื่องมือแพทย์อื่นๆ ที่กำหนดให้ต้องประเมินและลดความเสี่ยง เช่น
- IEC 60601-1 ลดความเสี่ยงเครื่องมือแพทย์ที่เกิดจากไฟฟ้าเช่น การลัดวงจร ความผิดพลาดเชิงเดียว การใช้งานด้านไฟฟ้า
- IEC 62304 ความเสี่ยงจากเครื่องมือแพทย์ที่มีซอฟท์แวร์ ในการทำงาน เช่น รักษา ติดตามผู้ป่วยจากซอฟท์แวร์
- ISO10993 การประเมินความเสี่ยง จากวัตถุดิบและเครื่องมือแพทย์ ทีต้องสัมผัสกับผู้ป่วยหรือผู้ใช้ หรือ เป็นการบริหารความเสี่ยงจากความเข้ากันได้ทางชีวภาพ (Biocompatibility)
ยังมีมาตรฐานอื่นๆ ที่กล่าวถึง การบริหารความเสี่ยงและต้องจัดทำ
การบริหารความเสี่ยง ต้องจัดทำการบริหารตลอดวงจรชีวิตของเครื่องคือ การออกแบบ การผลิต การใช้งานและการทิ้งทำลาย
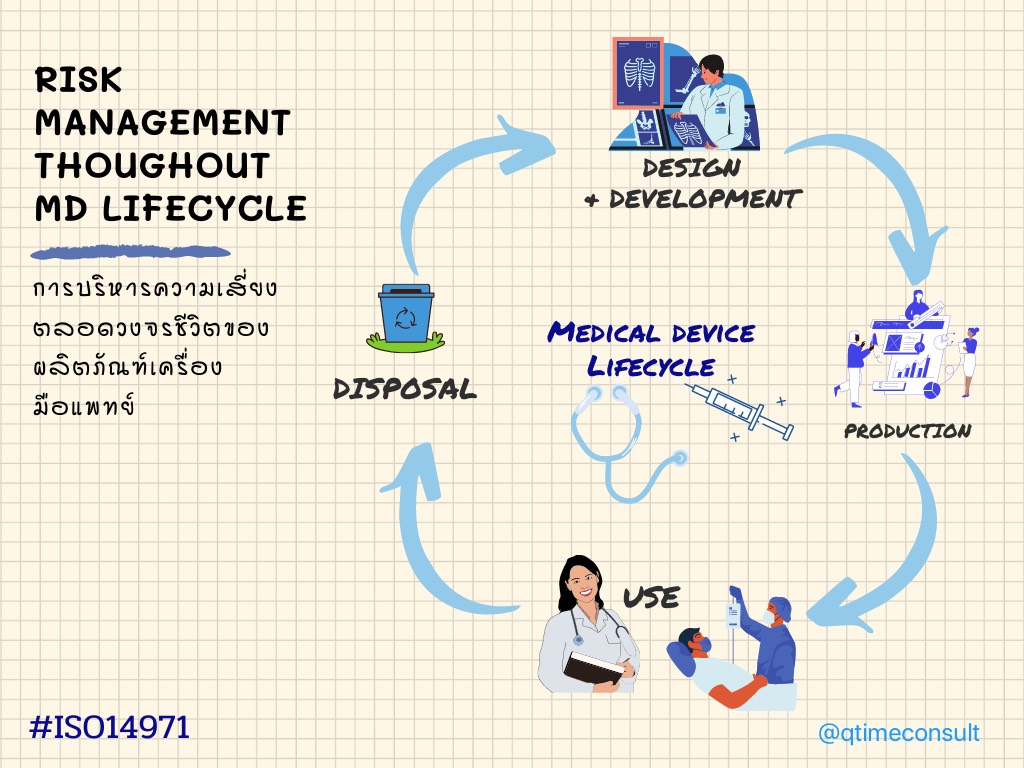
แนวทางการบริหารความเสี่ยง Risk Management ตามวงจรของ ISO 14971 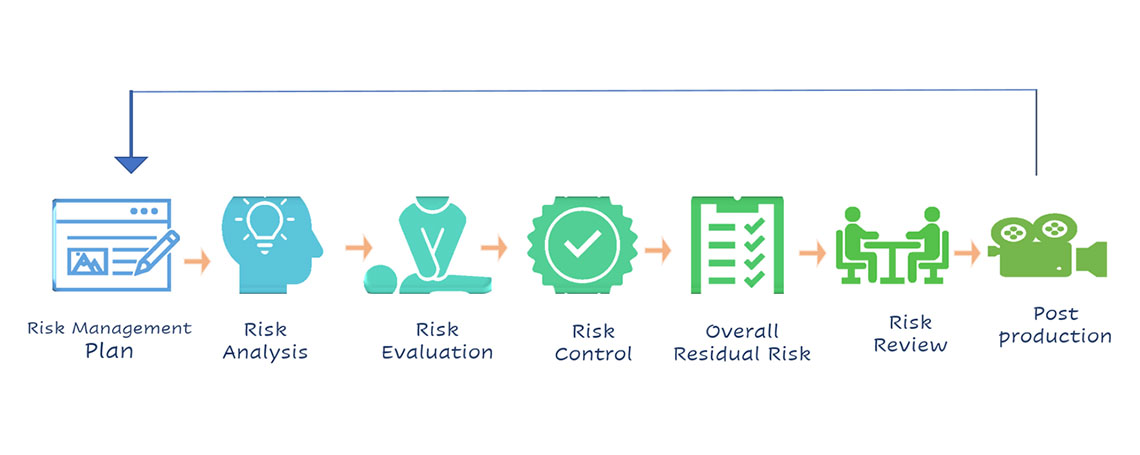
Figure: 1 Risk Management Flow
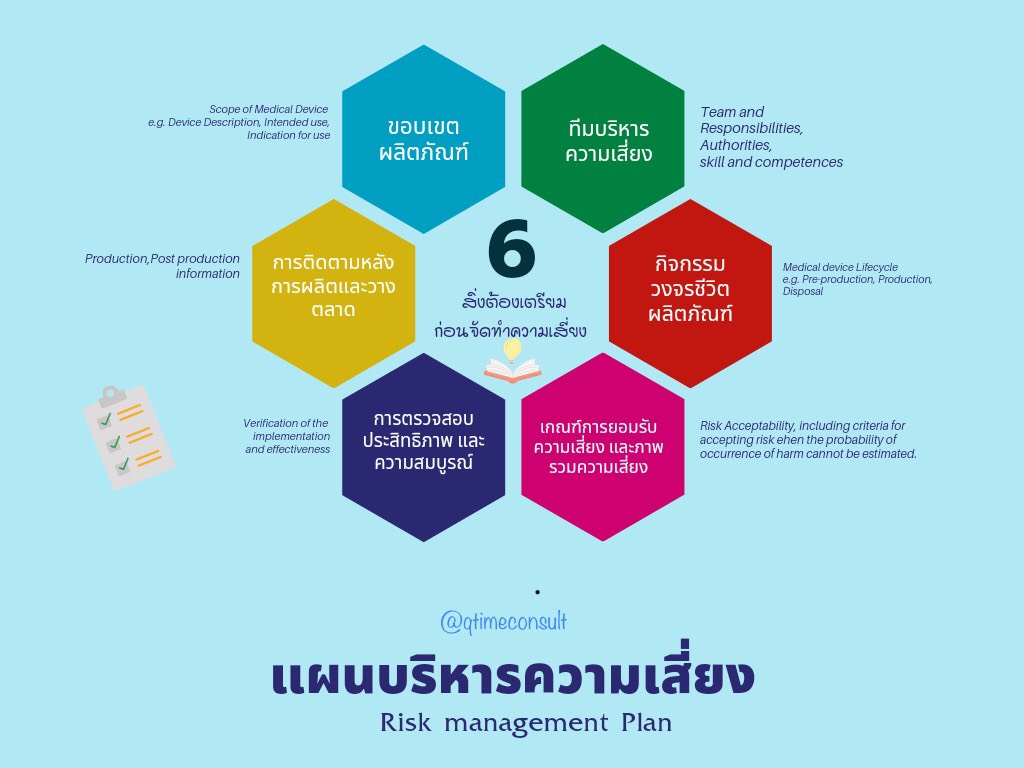
- การเตรียมและกำหนดแผนการบริหารความเสี่ยง (Risk Management Plan) โดยครอบคลุมตลอดวงจรของการบริหารความเสี่ยง (Medical Device Life cycle) ตั้งแต่การกำหนดผู้รับผิดชอบ การจัดการอบรมและประเมินทักษะของทีม การกำหนดขอบเขตของผลิตภัณฑ์เครื่องมือแพทย์และผลิตภัณฑ์ที่เกี่ยวข้องหรือใช้ร่วม ใช้ต่อพ่วง (Accessary) ต้องประเมินร่วมด้วย การจัดทำแผบบริหารความเสี่ยงครอบคลุมประเด็นเหล่านี้เป็นอย่างน้อย คือ
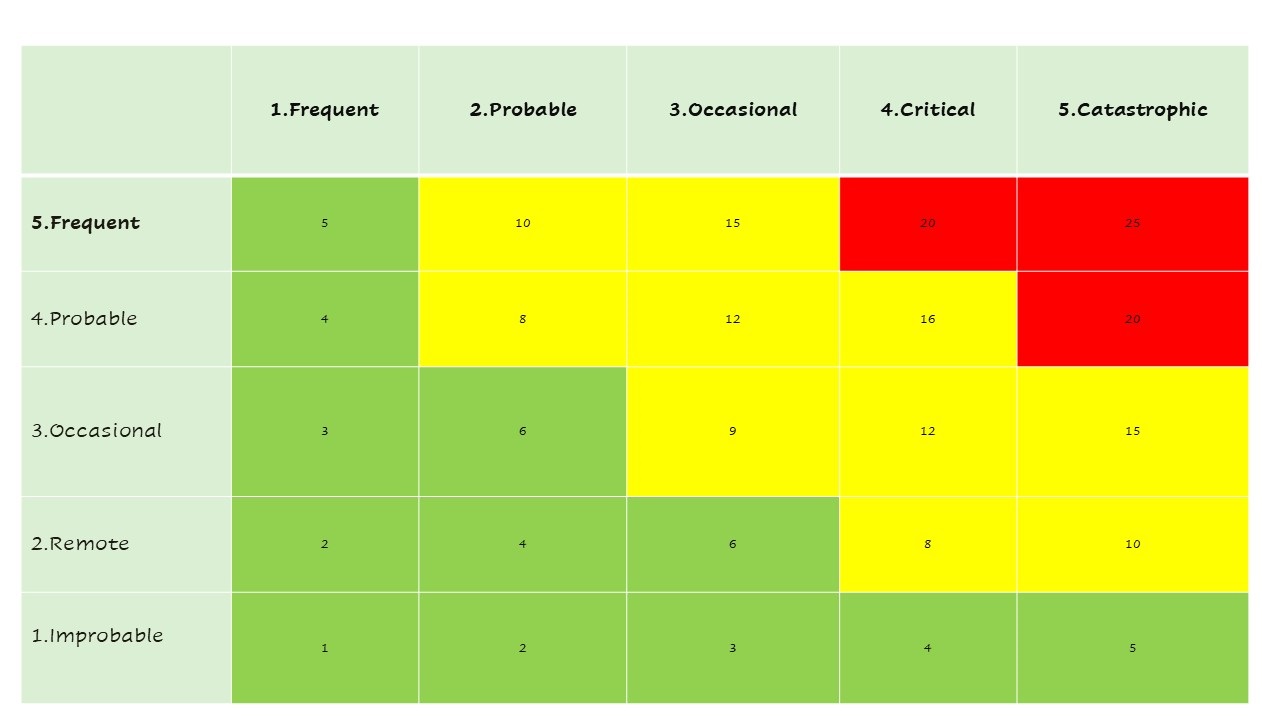
- การวิเคราะห์ความเสี่ยง (Risk Analysis) ประกอบด้วยการระบุแหล่งที่มาของความเสี่ยง (Hazard) การวิเคราะห์เหตุการณ์และสถานการณ์ที่นำไปสู่อันตราย (Hazardous Situation) และอันตรายหรือความเสี่ยงที่ผู้ป่วยและผู้ใช้จะได้รับผลกระทบ โดยใช้เครื่องมือ (Tools) วิธีการ หรือเทคนิค ต่างๆ มาใช้ประกอบการประเมิน เครื่องมือหนึ่งที่นิยมและเป็นที่รู้จักคือ FMEA – Failure Mode and Effects Analysis หรือใช้เครื่องมืออื่นๆ มีช่วยในการประเมิน การบ่งชี้ เพื่อให้เข้าถึงความเสี่ยงได้อย่างแท้จริง เช่น การใช้ PHA-Preliminary Hazard analysis, Taguchi analysis. ใน ISO14971 มีหลักการแนวทางใช้ร่วมการวิเคราะห์ เช่น Annex A บ่งชี้คุณลักษณะของเครื่องมือแพทย์ การระบุแหล่งที่มาของอันตรายโดยใช้ Annex C เป็นต้น การประมานความเสี่ยงโดยใช้ โอกาสเกิด (Probability) และ ความรุนแรง (Severity)
- การประเมินความเสี่ยง (Risk Evaluation) โดยการกำหนดเกณฑ์การยอมรับความเสี่ยง สอดคล้องกับนโยบายด้านความเสี่ยงเครื่องมือแพทย์ขององค์กร กฎหมายกฎระเบียบ ข้อบังคับที่เกี่ยวข้องกับเครื่องมือแพทย์นั้น หากการประเมินไม่สามารถยอมรับได้ ต้องดำเนินการเข้าสู่การกำหนดมาตรการควบคุมความเสี่ยงนั้น
- การควบคุมความเสี่ยง (Risk Control) มาตรการที่จะควบคุมความเสี่ยง สามารถกำหนดได้ตั้งแต่การเริ่มการออกแบบและพัฒนาเครื่องมือแพทย์ การควบคุมในกระบวนการผลิต และการให้ข้อมูลกับผู้บริโภคหรือ ผู้ใช้และผู้ป่วย หากมาตรการมีประสิทธิภาพเพียงพอ ความเสี่ยงจะลดระดับได้ แต่มาตรการควบคุมที่กำหนดอาจจะก่อให้เกิดความเสี่ยงใหม่ (Risk arising from risk control measure) ทีมบริหารความเสี่ยง ต้องพิจารณาในประเด็นนี้ และเพิ่มการประเมินความเสี่ยงที่เกิดใหม่นี้อีกครั้ง และความเสี่ยงที่ยังไม่สามารถยอมรับได้ ทีมบริหารความเสี่ยงต้องจัดทำการรายงานให้เห็นถึงประโยชน์ -ความเสี่ยง (Benefit -Risk)
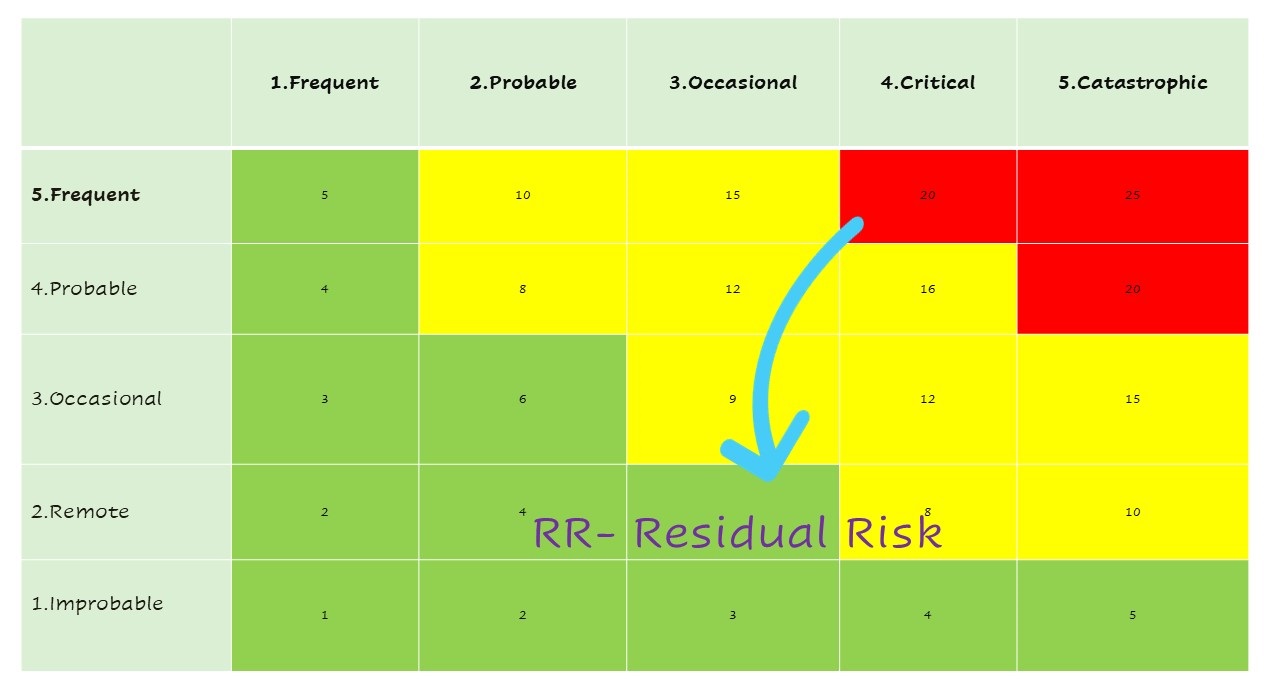
- ประเมินภาพรวมความเสี่ยงที่ยังหลงเหลือ (Evaluation of Overall residual Risk) จากการประเมินความเสี่ยงตลอดวงจรชีวิต MD แล้ว จัดทำการสรุปเพื่อให้เห็นความเสี่ยงที่ยังคงต้องพิจารณา หาแนวทางการลดความเสี่ยงนั้น หรือนโยบายขององค์กรต้องดำเนินการอย่างไรต่อไป
- การทบทวนการบริหารความเสี่ยง กระบวนการบริหารความเสี่ยงต้องได้รับการทบทวนในแต่ละขั้นตอนการจัดการความเสี่ยง ได้แก่ การทบทวนแผนบริหารความเสี่ยง (Risk Management Plan) การทบทวนเกณฑ์การประเมินและเกณฑ์การยอมรับ (Risk acceptability criteria) การทบทวนรายงาน (Risk Management Report)
- ข้อมูลผลิตและหลังการผลิต (Production and Post Production activities) จัดทำแผนการเข้าถึงข้อมูลการผลิตและข้อมูลหลังผลิต กำหนดแหล่งข้อมูล ผู้รับผิดชอบและระยะเวลาที่เหมาะสม ครอบคลุมตลอดห่วงโซ่และวงจรชีวิตของเครื่องมือแพทย์ การเก็บรวบรวมข้อมูล (Data collection) และมาทบทวน ประเด็นที่ได้นำมาดำเนินการ (Action) เช่น การออกแบบและพัฒนาเครื่องมือแพทย์ใหม่ การปรับปรุงทบทวนความเสี่ยง กลับเข้าสู่กระบวนการวางแผนบริหารความเสี่ยงอีกครั้ง
สรุปภาพรวมการบริหารความเสี่ยงสำหรับเครื่องมือแพทย์ มีความสำคัญและต้องจัดทำให้ครอบคลุมตลอดวงจรอายุ MD และผลจากการประเมินความเสี่ยงต้องสามารถ ลดความเสี่ยงให้กับผู้ใช้และผู้ป่วยได้อย่างแท้จริง ครบถ้วน ลดเหตุไม่พึงประสงค์ (Adverse event & Potential Adverse effect ) ที่อาจเกิดขึ้นจากการใช้ MD ได้
ดังนั้นแนวทางในการจัดทำ Risk Management ควรอย่างยิ่งต้องทำอย่างเป็นระบบตามวงจรการบริหารความเสี่ยง สอดคล้องตามมาตรฐาน ISO13485 รวมไปถึงกฎระเบียบข้อบังคับ เช่น CE Marking , FDA และ หน่วยงานกำกับดูแล
♥ Key Take aways ♥
- Life cycle of Medical Device การบริหารความเสี่ยงเปรียบได้ว่าเป็นหัวใจของเครื่องมือแพทย์ เพื่อให้มั่นใจในความปลอดภัยของผู้ป่วยและผู้ใช้ ตลอดวงจรของเครื่องมือแพทย์
- Post Production & Post Market Surveillance การติดตามความเสี่ยงอย่างต่อเนื่อง เพื่อนำข้อมูลหลังวางจำหน่ายหรือหลังการผลิต มาพัฒนาปรับปรุง ออกแบบผลิตภัณฑ์ ปรับปรุงกระบวนการและความเสี่ยง
- Update New Regulations การติดตามและ update กฎระเบียนข้อบังคับอยู่เสมอ เพื่อให้มีความสอดคล้อง เป็นไปตามข้อกำหนดทางกฎหมาย เช่น ISO14971 ข้อกำหนดจากหน่วยงานกำกับดูแล
- State of the art เทคโนโลยีใหม่ อาจเป็นส่วนช่วยให้ลด กำจัดหรือป้องกันความเสี่ยงได้ เครื่องมือแพทย์จึงต้องการพัฒนาอย่างต่อเนื่อง เพื่อให้สอดคล้องกับเทคโนโลยีที่ก้าวหน้าและความต้องการด้านสุขภาพที่เปลี่ยนแปลงไป
Download: 10 Steps for Risk Management
#Risk Management Virtual training
แหล่งที่มาข้อมูล
- ISO14971:2019 Medical devices - Application of risk management to medical devices
- ISO/TR 24971:2020 Medical devices -Guidance on the application of ISO14971

