
Clinical Evaluation Report
การประเมินผลทางคลินิกหรือทางการแพทย์ (Clinical Evaluation) หมายถึงกระบวนการหรือขั้นตอนการเก็บข้อมูลทางการแพทย์และการประเมินข้อมูลทางคลินิกที่เกี่ยวข้องกับผลิตภัณฑ์ ในที่นี่ที่ปรึกษาคิวไทม์ ขอกล่าวถึงเครื่องมือแพทย์ (Medical Device) เพื่อจะประเมินว่า เครื่องมือแพทย์นั้นๆ มีข้อมูลทางการแพทย์เพียงพอที่จะยืนยันความปลอดภัยและประสิทธิภาพของเครื่องมือแพทย์หรือไม่
ความหมายของ Clinical Evaluation
- อ้างอิงจาก ISO13485:2016 (3.3):assessment and analysis of clinical data pertaining to a medical device to verify the clinical safety and performance of the device when used as intended by the manufacturer. การประเมินและวิเคราะห์ข้อมูลทางด้านคลินิคที่เกี่ยวข้องกับเครื่องมือแพทย์นั้นๆ เพื่อตรวจสอบความปลอดภัยทางด้านการแพทย์และประสิทธิภาพของเครื่องมือแพทย์เมื่อใช้ตามวัตถุประสงค์ตามผู้ผลิตเครื่องมือแพทย์กำหนดไว้
- อ้างอิงจาก MEDDEV 2.7/1 rev.4 : Clinical Evaluation: a methodologically sound ongoing procedure to collect, appraise and analyze clinical data pertaining to a medical device and to evaluate whether there is sufficient clinical evidence to confirm compliance with relevant essential requirements for safety and performance when using the device according to the manufacturer’s instructions for use. วิธีการที่เป็นระเบียบแบบแผน ในการรวบรวมประเมินและวิเคราะห์ข้อมูลทางคลินิคที่เกี่ยวข้องกับเครื่องมือแพทย์ เพื่อประเมินถึงหลักฐานทางการแพทย์ที่มีอยู่เพียงพอหรือไม่ที่จะยืนยัน ตามข้อกำหนดที่สำคัญของเครื่องมือแพทย์นั้น เพื่อความปลอดภัยและประสิทธิภาพ เมื่อใช้เครื่องมือแพทย์ตามคำแนะนำในการใช้งานของผู้ผลิต
ความหมายของ Clinical Investigation :-
- Clinical Investigation การสืบทวนหรือการวิจัยทางคลินิก หมายถึงการวิจัยหรือการศึกษาอย่างเป็นระบบที่กระทำดำเนินการกับมนุษย์ มากกว่าหนึ่งคนขึ้นไป เพื่อประเมินความปลอดภัยและสมรรถนะหรือประสิทธิภาพของเครื่องมือแพทย์ เพื่อประเมินว่าเครื่องมือแพทย์เหมาะสมกับจุดมุ่งหมายและผู้ใช้ หรือผู้ป่วยตามกลุ่มโรคที่ได้ตั้งใจไว้
ตัวอย่าง กฎหมาย กฎระเบียบ ข้อบังคับที่เกี่ยวข้อง กับ Clinical Evaluation และ Clinical Investigation
- CE Marking for Medical Device (EU MDR2017/745) : Clinical evaluation and PMCF, Annex XV & Articles 61-82 : Clinical investigation โดยการประเมิน การวิเคราะห์ การสรุปผลและการจัดทำรายงานผลการประเมิน
- ASEAN Medical Device Directive (AMDD) หรือกฎหมายอาเชียนว่าด้วยเรื่องเครื่องมือแพทย์ Annex 8: Clinical Investigation
ทั้งสองกฎหมายคือ EU & ASEAN กำหนดให้เครื่องมือแพทย์ที่ต้องการยื่นขอการรับรองหรือ การขึ้นทะเบียนต้องจัดทำรายงานการประเมินผลด้านคลินิก ตามวัตถุประสงค์ข้างต้น การจัดทำรายงานคลินิก ต้องสามารถตอบยืนยันประสิทธิภาพและความปลอดภัย ใน GSPR checklist of MDR (Annex I) และ Essential Principle checklist of CSDT (Annex I) และ เป็นส่วนหนึ่งที่อยู่ Technical Document file และ/ หรือ CSDT File (Common Submission Dossier Template).
MEDDEV 2.7.1 rev.4
MEDDEV 2.7.1 rev.4 เป็น Guidelines ที่ยอมรับใช้เป็นแนวทาง การจัดทำรายงานผลการประเมินทางด้านคลินิค ซึ่งใน MEDDEV 2.7.1 แบ่งขั้นตอนการประเมิน เป็น stages 0-4 คือ
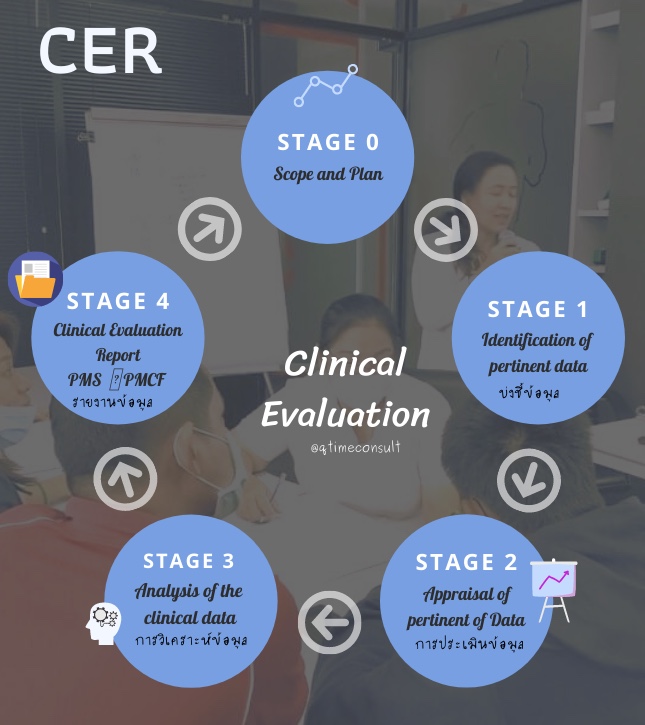
Clinical Evaluation for Medical Device Stage 0-4
- Stage 0 : กำหนดขอบเขตของการจัดทำการประเมินด้านคลินิกและจัดทำแผน (Define the scope of the clinical evaluation and create a plan)
- กำหนดขอบเขต วัตถุประสงค์การใช้งานและรายละเอียดของเครื่องมือแพทย์ สรุปการเปรียบเทียบผลิตภัณฑ์ (Device Equivalence) ทั้ง 3 ด้าน คือ Biological ด้านชีวภาพ / Technical ด้านเทคนิค / Clinical ด้านคลินิค
- กำหนดบทบาทหน้าที่และคุณสมบัติของผู้ประเมิน (Clinical Evaluator /Author)
- Stage 1 : การกำหนดข้อมูลที่ต้องการประเมิน และกลยุทธ์การค้นหางานรายงานวิจัย(Identify data to be appraised and the literature search strategy)
- การกำหนดแหล่งที่มาข้อมูลทางคลินิก ต้องเป็นแหล่งที่น่าเชื่อถือและเกี่ยวข้องกับผลิตภัณฑ์ แหล่งข้อมูลที่นิยมและเป็นที่รู้จัก เช่น MEDLINE, PUBMED และยังมีอีกหลากหลายแหล่งข้อมูล ทั้งนี้ขึ้นอยู่กับผู้ผลิตหรือผลิตภัณฑ์พิจารณาความเหมาะสมและเหตุผลที่ต้องการใช้แหล่งข้อมูล
- กำหนดวิธีการหรือกลยุทธ์ที่จะเก็บรวบรวมข้อมูลที่สอดคล้อง และตรงกับขอบเขตและเป้าหมาที่กำหนดไว้
- Stage 2 : การประเมินข้อมูลที่เกี่ยวข้องและการสรุปผล (Appraise relevant data and summarize data sets)
- การประเมินคุณภาพของงานวิจัยหรือบทบรรณานุกรม (Literature)ที่ได้รวบรวมได้ สามารถประเมินในเชิงคุณภาพ (Qualitative) หรือ ในเชิงประมาณ (Quantitative)
- Stage 3 : การวิเคราะห์ข้อมูลจากข้อมูลที่ค้นพบและสอดคล้องตามที่กำหนด (Perform analysis of data to see if it meets requirements)
- การวิเคราะห์สรุปผลด้านคลินิกจากงานวิจัยหรือบทบรรณานุกรมที่ค้นพบ และรวบรวม กล่าวถึงความปลอดภัยและประสิทธิภาพของเครื่องมือแพทย์
- จัดทำ Benefit-Risk ประโยชน์-ความเสี่ยง หลังจากที่ทีมผู้ประเมินผลทางคลินิค (Clinical Evaluation) ได้รวบรวมผลแล้ว จัดทำสรุปที่ได้จากเนื้อหา ให้เห็นว่าผลิตภัณฑ์เครื่องมือแพทย์ มีประโยชน์หรือความเสี่ยงมากน้อย เท่าไหร่ ในเชิงปริมาณหรือคุณภาพ
- จัดทำ ทบทวนคู่มือการใช้งานเครื่องมือแพทย์ (Instruction for use)
- Stage 4 : จัดทำรายงาน (Compile the clinical evaluation report (CER))
- จัดทำรายงาน จาก Stage 1 – 3
- จัดทำแผน Post Market Surveillance (PMS), Post Market Clinical Follow up Plan (PMCF) และ Vigilance system
- ลงชื่อผู้จัดทำ ผู้ทบทวน ผู้อนุมัติ รวมถึง ผู้เชี่ยวชาญหรือ Clinical Evaluator /Author
♥ key Take Away ♥
- “Clinical evaluation is a mandatory requirement” การประเมินผลทางคลินิก สำหรับผู้ผลิตและส่งออก โดยเฉพาะอย่างยิ่งใน EU เครื่องมือแพทย์ต้องจัดทำการประเมินผลด้านคลินิกทุก Risk Class
- “Clinical evidence must be based on scientific evidence” การได้ข้อมูลจากการทดลองหรือศึกษาด้านคลินิกจากการทบทวนวรรณกรรม ที่ได้มีการทดสอบในมนุษย์ ตามวัตถุประสงค์ของเครื่องมือแพทย์ (Clinical trials)
- “Clinical evaluation must be proportionate to the risk of the device” การวิเคราะห์ความเสี่ยงและการใช้หรือการรักษาจากเครื่องมือแพทย์
- การประเมินผลทางคลินิก ต้องมีข้อมูลใหม่ๆ ทันสมัยและทันต่อเทคโนโลยี (State of the art) ทันต่อความต้องการและความจำเป็นทางด้านสุขภาพและทางการแพทย์
- การประเมินต้องเป็นผู้เชี่ยวชาญทางการแพทย์ (Qualified Expert or Specialist) เพื่อทบทวน วิเคราะห์ผล ความเสี่ยง ผลกระทบ ทั้งก่อนรักษาและหลังรักษา (Pre-Post treatment)
สรุป Clinical Evaluation ข้อมูลที่ต้องระบุใน CER -Clinical Evaluation Report
- ผลิตภัณฑ์ Device Description
- Literature Review
- Post Market Surveillance
- Post Market Clinical Follow up (PMCF)
- Vigilance System
- Risk Management
หลังจากได้ทำสรุปและผ่านการอนุมติ CER -Clinical evaluation Report แล้ว ผู้ผลิตต้องติดตามผลทาง Clinical ของผลิตภัณฑ์ที่ปล่อยสู่ตลาด เพื่อนำข้อมูลการพัฒนาผลิตภัณฑ์ ความเสี่ยง และข้อมูลอื่นๆ เพื่อลดความเสี่ยงให้กับผู้ใช้และผู้ป่วยต่อไป
GCP -Good Clinical Practice
ในกรณีที่ต้องมีการจัดทำ Clinical Investigation ต้องปฏิบัติตามแนวทาง GCP -Good Clinical Practice ตามที่หน่วยงานกำกับดูแลประกาศ หรืออีกมาตรฐาน Guidelines : ISO14155 แนวทางปฏิบัติที่ดีสำหรับการสอบสวนทางคลินิกหรือการนำทดลองใช้กับมนุษย์ตามวัตถุประสงค์เครื่องมือแพทย์กำหนด ซึ่งการดำเนินการต้องเป็นไปตามมาตรฐานทางวิทยาศาสตร์และจริยธรรม เช่น
การคุ้มครองสิทธิและความปลอดภัยของอาสาสมัคร (Protection of Human Subjects)
ความน่าเชื่อถือและความสมบูรณ์ของข้อมูล (Data Reliability and Integrity)
การแสดงถึงความสอดคล้องกับหลักการพื้นฐานที่จำเป็น (Conformity with Essential Priciples) เรื่องประสิทธิภาพและความปลอดภัย (Performance and Safety) การชั่งน้ำหนักได้ถึงประโยชน์และความเสี่ยง (Benefit -Risks) โดยรวมในเชิงบวก หรือ Positive Overall Benefit-RiskRatio) สำหรับผู้ป่วย
บทสรุปส่งท้ายนี้ เครื่องมือแพทย์ โดยเฉพาะที่มีวัตถุประสงค์ทางการแพทย์ จำเป็นต้องได้รับการประเมินทางคลินิก (Clinical Evaluation Report -CER) ก่อน เพื่อรวบรวมและวิเคราะห์ข้อมูลทางคลินิกที่เกี่ยวข้อง และอาจจะไม่จำเป็นจำเป็นต้องดำเนินการสอบสวนทางคลินิกกับมนุษย์ (Clinical Investigation) ใหม่ แต่ทั้งนี้ขึ้นอยู่กับประกาศของหน่วยงานกำกับดูแลประกาศ หรือ Conformity Assessment Procedure ด้วย
VDO Clinical Evaluation
Our Services :
- บริการให้คำปรึกษา
- จัดทำรายงานการประเมินผลทางคลินิก หรือ Clinical Evaluation Report
- Clinical Evaluation Training
- Clinical Evaluation / PMCF /Post Market surveillance
บทความที่เกี่ยวข้อง
Clinical Evaluation Introduction
4 เคล็ดลับเพื่อการเตรียมจัดทำรายงาน
แหล่งอ้างอิงข้อมูล
GUIDELINES ON MEDICAL DEVICES, MEDDEV 2.7.1 rev.4, June 2016. Clinical Evaluation. MEDDEV 2.7/1 revision 4, Clinical evaluation: a guide for manufacturers and notified bodies (medical-device-regulation.eu)
EU MDR2017/745. Chapter VI: Clinical Evaluation and Clinical Investigations, Annex XIV. REGULATION (EU) 2017/ 745 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL - of 5 April 2017 - on medical devices, amending Directive 2001/ 83/ EC, Regulation (EC) No 178/ 2002 and Regulation (EC) No 1223/ 2009 and repealing Council Directives 90/ 385/ EEC and 93/ 42/ EEC (europa.eu)
ASEAN Medical Device Directive

