
GMP Medical Device
สุขลักษณะที่ดีในการผลิตเครื่องมือแพทย์
ในบทความนี้ขอรีวิว GMP สำหรับผู้ผลิตเครื่องมือแพทย์ อ้างอิง พรบ. 2548 ที่ประกาศโดย สำนักงานอาหารและยา ก่อนอื่น เราจะได้ยินและคุ้น
เคยกับ GMP อาหาร , เครื่องสำอาง, อาหารสัตว์ และ GMP อื่น ๆ โดยเน้นในอุตสาหกรรมการผลิตผลิตภัณฑ์ที่เกี่ยงข้องกับสุขภาพ อนามัยของคน เช่น GMP อาหารสัตว์เป็นอาหารสัตว์ที่คนต้องนำมาปรุง แปรรูป บริโภค จึงทำให้ต้องดูแล ควบคุมเพื่อลดการปนเปื้อนตลอดห่วงโซ่ GMP Medical Device ก็เช่นเดียวกัน เป็นมาตรฐานที่ต้องการให้ผู้ป่วยและผู้ใช้เครื่องมือแพทย์ มีความปลอดภัยและได้รับประสิทธิภาพที่ดีจากเครื่องมือแพทย์
GMP Medical Device & ISO13485 คู่เทียบ
ข้อกำหนด GMP เครื่องมือแพทย์ ในที่นี้ ขอนำ ฉบับปี 2548 มาทบทวน กัน โดยข้อกำหนด GMP แบ่งเป็น 5 หมวด หากลองเปรียบเทียบ กับมาตรฐาน ISO13485 ที่เป็นมาตรฐานหลักสากลที่ผู้ส่งออก หรือผู้ที่ต้องขอการรับรองมาตรฐาน CE Marking for Medical Device, USFDA และข้อกำหนดของแต่ละประเทศ ที่ต้องการให้ผ่านการรับรอง ISO 13485 เป็นพื้นฐาน
- ข้อกำหนด GMP เครื่องมือแพทย์
ภาพรวม GMP medical device คือมีโครงสร้างข้อกำหนดของระบบบริหารคุณภาพ เช่นเดียวกับ ISO9001 หรือ ISO13485 ผู้ผลิตที่มีความคุ้นเคยหรือได้ประยุกต์ใช้ระบบอยู่แล้ว ยังคงใช้แนวทางของมาตรฐานระบบคุณภาพมาใช้กับ GMP ได้เช่นเดียวกัน สิ่งที่เพิ่มเติมคือข้อกำหนดที่เข้าถึงการผลิตเครื่องมือแพทย์ ที่ต้องควบคุมพิเศษในระหว่างการผลิต เช่น ข้อกำหนดเครื่องมือแพทย์ที่ต้องปราศจากเชื้อ (Sterilization) หากมีการผลิตและเป็นเงื่อนไขของผลิตภัณฑ์ ผู้ผลิตต้องประยุกต์ใช้และให้ความสำคัญในกระบวนการนี้ หรือหากเงื่อนไขเครื่องมือแพทย์ ต้องมีการบำรุงรักษา ผู้ผลิตต้องกำหนดขั้นตอนปฏิบัติให้สอดคล้องเพื่อลดความเสี่ยง และมั่นใจในประสิทธิภาพให้กับผู้ใช้ เป็นต้น

- การประยุกต์ใช้ระบบ
GMP ย่อจาก Good Manufacturing Practice โดยชื่อได้ระบุขอบเขตไว้แล้ว ผู้ที่เหมาะสมในการประยุกต์ใช้ คือ ผู้ผลิตเครื่องมือแพทย์ สามารถประยุกต์ใช้ได้กับทุกห่วงโซ่ของการผลิตและการบริการเครื่องมือแพทย์ เช่น กระบวนการบรรจุใหม่ (Re-packing) กระบวนการประกอบขึ้นรูปเครื่องมือแพทย์ (Assembling) ก็สามารถประยุกต์ใช้ข้อกำหนด GMP ได้เช่นกัน
- การยกเว้นข้อกำหนด GMP
GMP medical device หรือระบบบริหารคุณภาพ ในการนำข้อกำหนดประยุกต์ใช้ หากกระบวนการ กิจกรรม การปฏิบัติงานขององค์กร ไม่มีกิจกรรมนั้น ๆ สามารถยกเว้นหรือไม่ประยุกต์ใช้ได้ (Non-Applicable) เช่น ไม่มีการออกแบบและพัฒนาผลิตภัณฑ์ใหม่ และประสงค์ต้องการยกเว้นการออกแบบ ก็สามารถทำได้เช่นกัน หรือกิจกรรม ผังธุรกิจ (Business Process) ไม่มีขั้นตอนการบริการซ่อมผลิตภัณฑ์ให้กับลูกค้าจึงไม่ได้นำทรัพย์สินใดใดของลูกค้ามาซ่อม ก็ระบุขอบเขต แสดงถึงการไม่ประยุกต์ใช้ได้ ( Non-applicable) และควรแสดงสาเหตุที่ไม่ประยุกต์ใช้ให้ชัดเจน
- การบูรณาการระบบ Integrated Management System
Integrated Management System (IMS) การบูรณาการณ์ระบบ หรือการควบรวมระบบระหว่าง GMPMD และ ISO9001 หรือ GMPMD และ ISO13485 ผู้ผลิตสามารถประยุกต์ใช้ในรูปแบบ Integrated ระบบได้เลย โดยทั้งนี้ มีข้อที่ควรต้องพิจารณา โดยเฉพาะในประเด็นสำคัญ เช่น เรื่องขอบเขตผลิตภัณฑ์ ขอบเขตเงื่อนไขขั้นตอนการผลิต และเงื่อนไขของเครื่องมือแพทย์ที่มีข้อบังคับ กฎระเบียบเฉพาะ ซึ่งหากมีข้อกำหนดพิเศษของผลิตภัณฑ์ แนะนำให้ผู้ผลิตมีการเปรียบเทียบข้อกำหนดที่ต้องประยุกต์ใช้ บ่งชี้สิ่งที่เหมือนหรือมีความแตกต่าง และกำหนดแนวทาง ทั้งนี้เพื่อไม่ให้เกิดความสับสนกับผู้ปฏิบัติงาน ในบางผู้ผลิตมีสินค้าที่ผลิตหลากหลายกลุ่ม การควบรวมระบบ (Integrated Management System) อาจจะไม่เหมาะสม อาจสร้างความสับสนในกระบวนการ ผู้ปฏิบัติงานไม่สามารถดำเนินการได้ อาจส่งผลกระทบต่อการผลิต ส่งผลต่อการบริหารจัดการระบบเอกสารและบันทึกคุณภาพ รวมถึงผลกระทบต่อผลิตภัณฑ์ ในด้านคุณภาพ และความปลอดภัยได้ การควบรวมระบบถือเป็นการบริหารจัดการที่ดี ช่วยลดเวลา ประหยัดค่าใช้จ่ายหลายด้าน เช่น ค่าใช้จ่ายด้านพนักงานเจ้าหน้าที่ ค่าใช้จ่ายการตรวจรับรอง การบำรุงรักษาสิ่งอำนวยความสะดวก ผู้ผลิตจึงต้องพิจารณาความเหมาะสมและแนวทางการบริหารระบบคุณภาพ
- รีวิข้อกำหนด
ข้อกำหนดของมาตรฐานที่ต้องนำไปประยุกต์ใช้ คือในข้อกำหนดที่ 2 มี 5 หมวด ในที่นี้ที่ปรึกษาขอรีวิวโดยการเทียบกับ ISO 13485 เพราะเป็นมาตรฐานระบบคุณภาพที่ตรงกับอุตสาหกรรมเครื่องมือแพทย์ที่สุด
ข้อกำหนด GMP Medical Device ในหมวดที่ 1 ระบบบริหารคุณภาพ และ ISO 13485 ในข้อกำหนดที่ 4
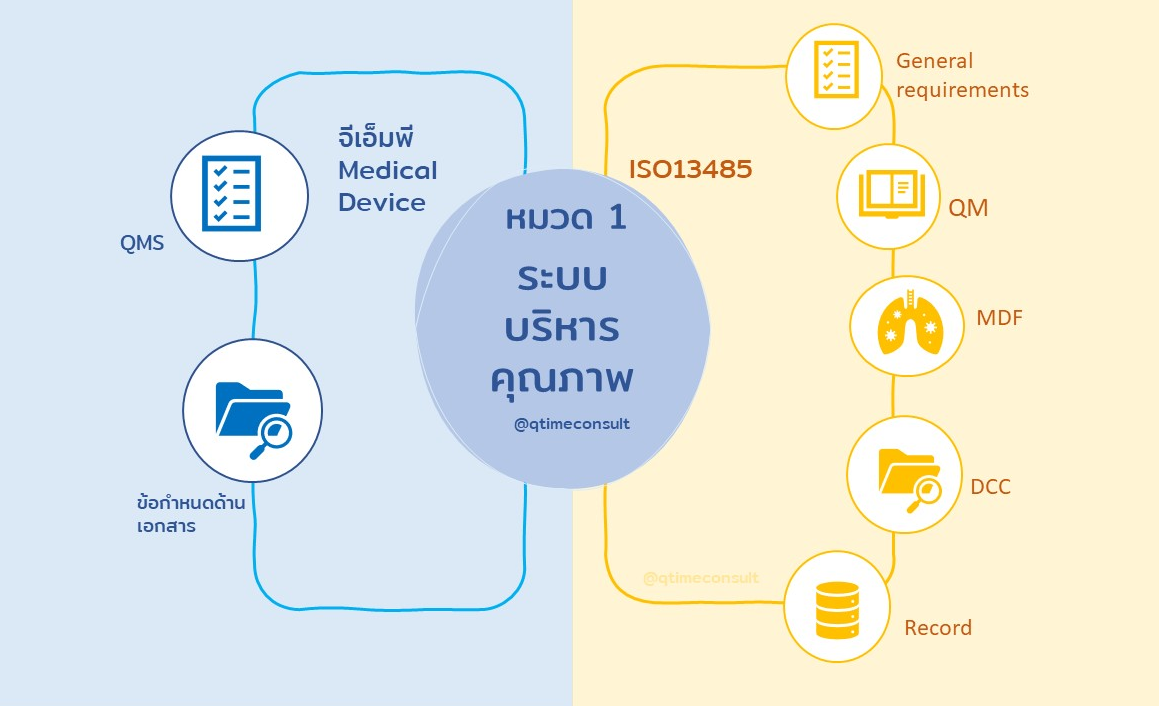
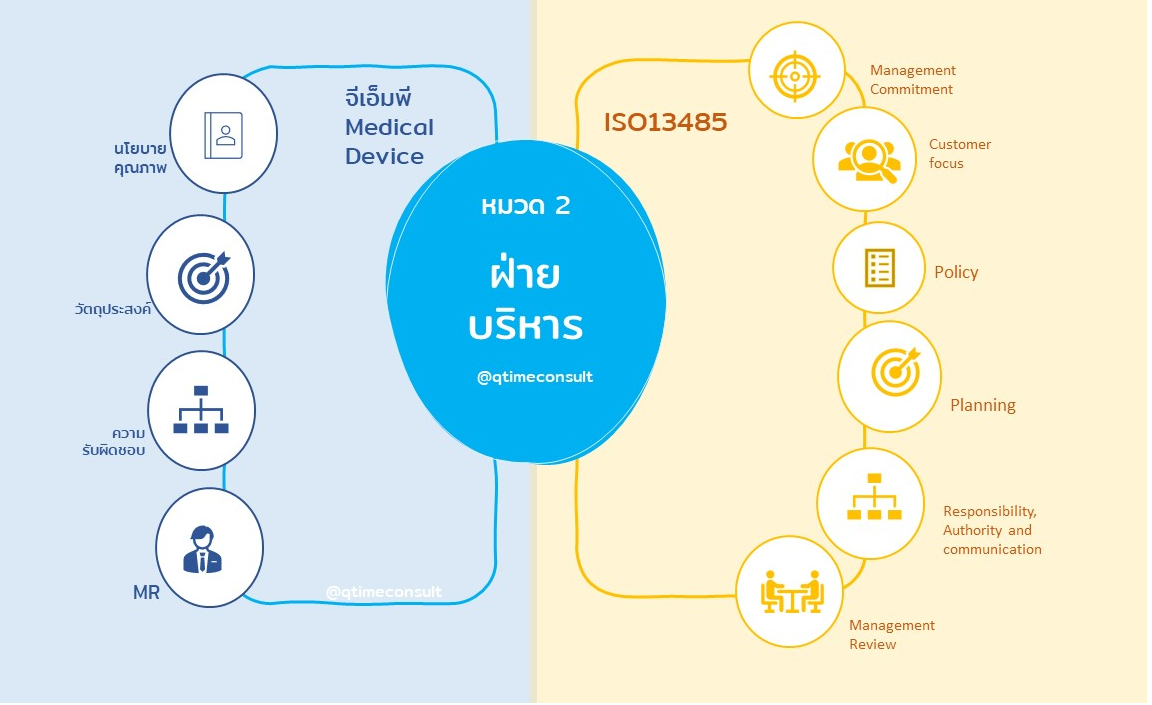
ข้อกำหนด GMPMD ในหมวดที่ 2 ฝ่ายบริหาร และ ISO13485 ข้อกำหนดที่ 5
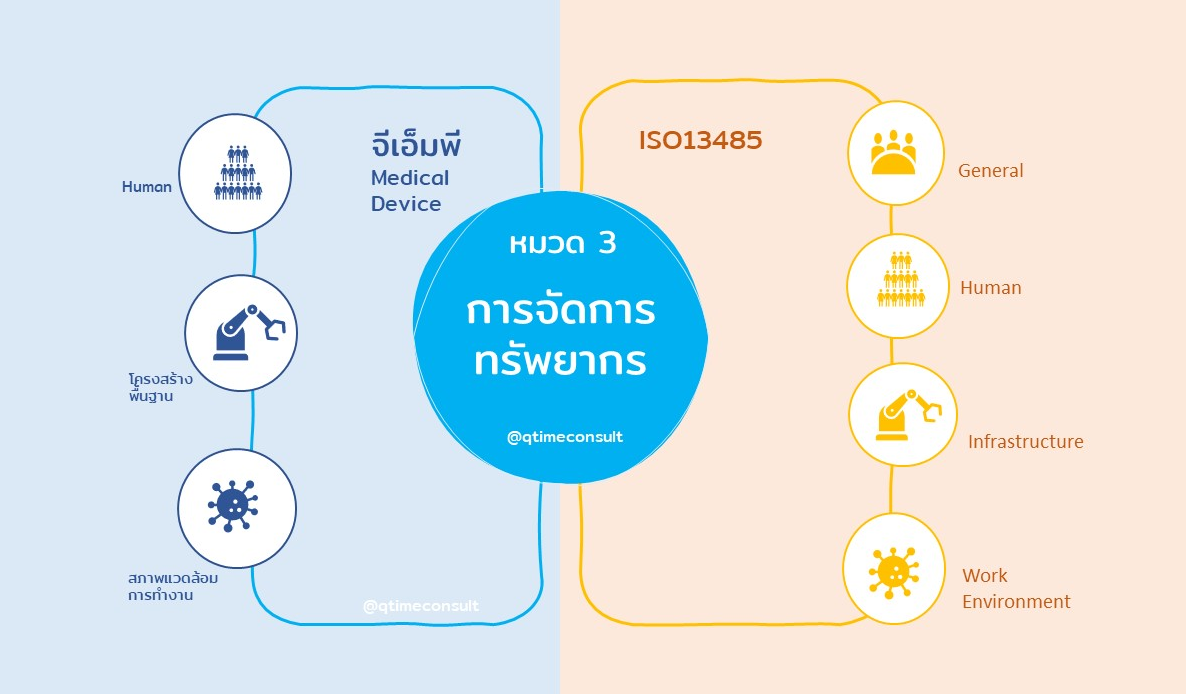
ข้อกำหนดหมวดที่ 3 การจัดการทรัพยากร และข้อกำหนดที่ 6
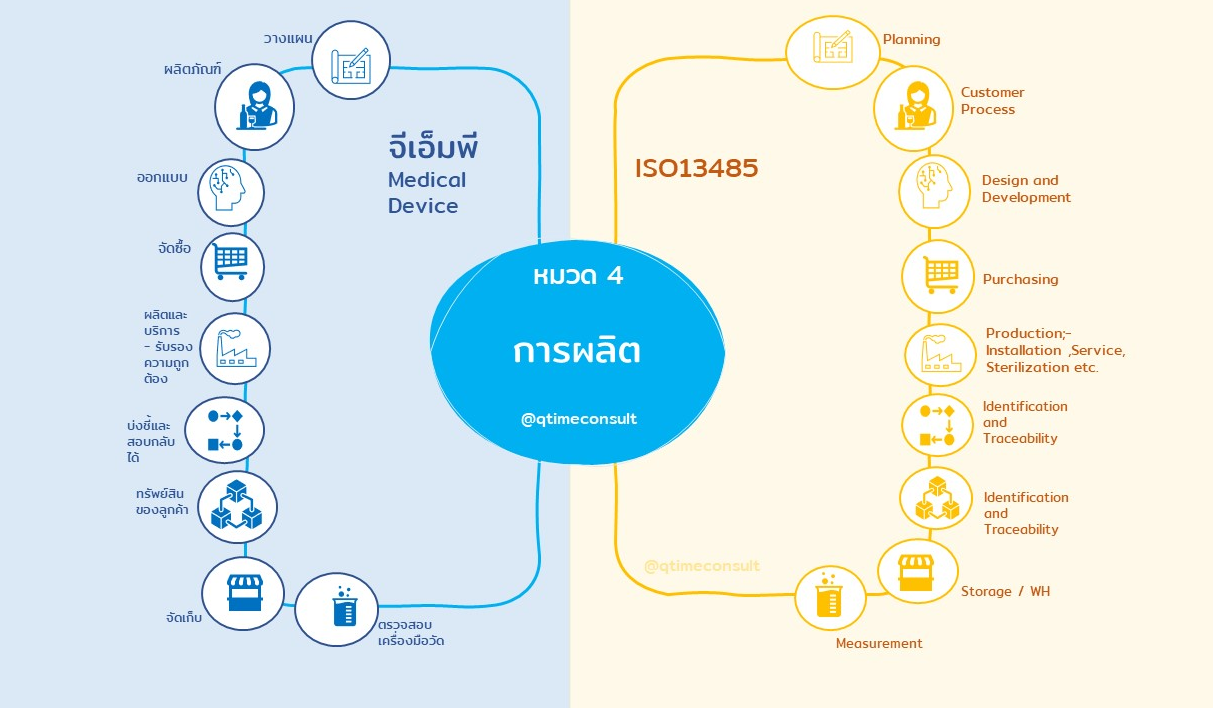
ข้อกำหนด หมวดที่ 4 การผลิต และข้อกำหนดข้อ 7 ISO13485
ข้อกำหนดหมวดที่ 5 การตรวจสอบ การทดสอบและการแก้ไข
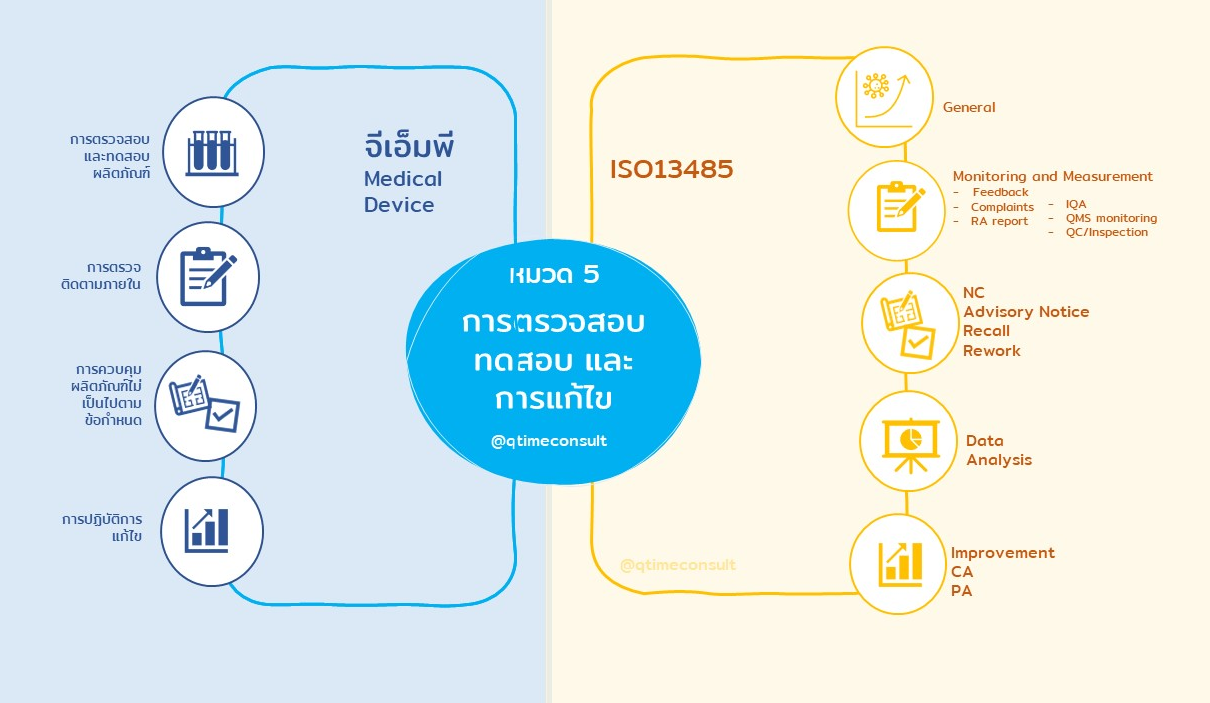
สรุปข้อกำหนด GMP Medical Device เมื่อมาเปรียบเทียบกับ ISO13485 มาตรฐานสากล โดยภาพรวมแล้วทุกข้อกำหนดของ GMP จะมีระบุอยู่ใน ISO13485 และบางข้อกำหนดในระบบมาตรฐาน ISO 13485 ในข้อกำหนด GMP จะยังไม่ได้ระบุหรือกำหนดไว้
Download : การเปรียบเทียบข้อกำหนด GMPMD และ ISO13485
แหล่งข้อมูล
- Guideline on the application of Thai GMP Medical devices
- ISO 13485:2016 Medical Devices - Quality Management systems-Requirements for regulatory purposes
#ISO13485
#GMPMedicalDevice

