
ISO13485 QMS for Medical Device
มาตรฐานบริหารคุณภาพสำหรับเครื่องมือแพทย์
ISO13485 เป็นมาตรฐานหนึ่งที่สำคัญสำหรับผู้ผลิตเครื่องมือแพทย์ หรือผู้ผลิตชิ้นส่วน อะไหล่เครื่องมือแพทย์ หรือบริการที่เกี่ยวข้องก็สามารถนำมาตรฐานนี้ ไปประยุกต์ใช้ได้ รวมถึงการนำไปประยุกต์ใช้แบบบูรณาการณ์หรือ Integrated Management system ร่วมกับมาตรฐานอื่น ๆ เช่น GMPMD, GDPMD, GMP cosmetic , ISO9001
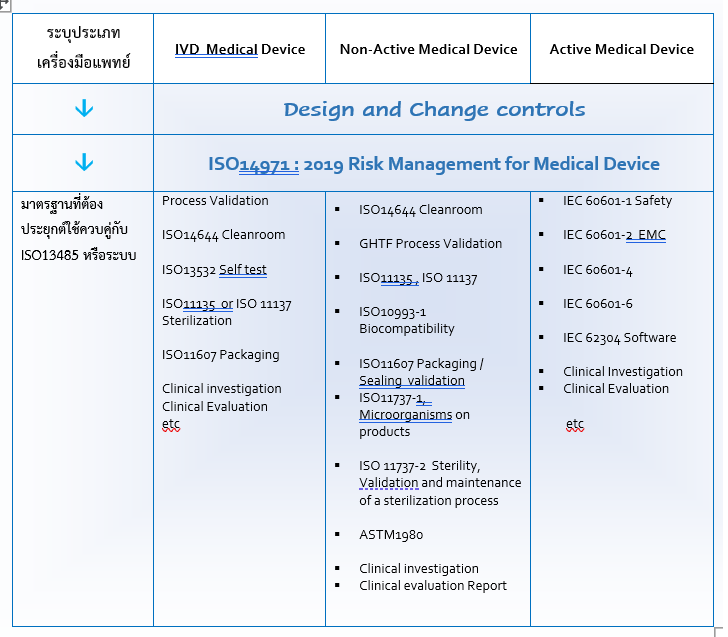
ตารางตัวอย่าง การประยุกต์ใช้ ระบบมาตรฐาน ISO13485 ร่วมกับมาตรฐานที่เกี่ยวข้องกับผลิตภัณฑ์เครื่องมือแพทย์ โดยพิจารณาตามประเภทของเครื่องมือแพทย์ คือ IVD เครื่องมือแพทย์ที่มีวัตถุประสงค์เพื่อวินิจฉัยโรค, Non-Active Medical Device เครื่องมือแพทย์ไม่มีไฟฟ้าเป็นกำลัง และสุดท้าย Active Medical Device เครื่องมือแพทย์ที่มีไฟฟ้าเป็นกำลัง
Table of Type of Medical Device and Related Standards &Regulations
FAQ – คำถามที่ถามบ่อย
Q : การประยุกต์ใช้ ต้องทำทุกมาตรฐานที่เกี่ยวข้องหรือไม่ ?
A: การประยุกต์ใช้มาตรฐานที่เกี่ยวข้อง ขึ้นอยู่กับเงื่อนไขของการผลิต และเงื่อนไขของ MD นั้น เช่น เป็นเครื่องมือแพทย์ ที่ต้องปราศจากเชื้อ จึงต้องใช้ ISO11135 หรือ ISO11137 มาประยุกต์ใช้ในขั้นตอนการทำให้ปราศจากเชื้อ โดยการ Validation เพื่อทวนสอบและยืนยันความปลอดภัยและประสิทธิภาพของกระบวนการปราศจากเชื้อได้ และนำมาทดสอบอีกครั้งด้วย ISO11737 เป็นต้น
สำหรับเครื่องมือแพทย์ ที่มีซอฟท์แวร์ ก็ควรต้อง Verification and Validation ด้วย IEC 62304 ด้วยเช่นกัน
Q : บริษัทต้องมีผู้เชี่ยวชาญเฉพาะด้านหรือทางการแพทย์หรือไม่
A : เช่นเดียวกับคำตอบข้างบน เครื่องมือแพทย์มีหลากหลาย มีระดับความเสี่ยงที่ไม่เท่ากัน มีความสำคัญ และความคาดหวังในการรักษาไม่เหมือนกัน ดังนั้น หากเครื่องมือแพทย์ที่มีความเสี่ยงสูง เช่น ฝังในร่างกาย เกี่ยวข้องกับการทำงานระบบประสาท ระบบหัวใจ ควรต้องมี Medical advisor แนะนำ แต่สำหรับกระบวนการผลิตสามารถ นำผู้ปฏิบัติงาน ฝึกอบรมเพิ่มเติมและติดตามการปฏิบัติงานในกระบวนการนั้นๆ ได้
Q : ระยะเวลาการให้คำปรึกษา จนถึงการยื่นขอการรับรอง
A: หากผู้ผลิตอยู่ในช่วงระยะเวลาเริ่มต้นทำระบบ ที่ปรึกษาจะเข้าประเมินที่หน้างาน หรือ ณ สถานที่ประกอบการก่อน ประเภทผลิตภัณฑ์เครื่องมือแพทย์ และรวมถึงกฎหมาย ข้อกำหนด กฎระเบียบที่เกี่ยวข้องกับเครื่องมือแพทย์ นั้น ทั้ง 3 ปัจจัยนี้ จะกำหนดระยะเวลาให้ได้อย่างแม่นยำ โดยเฉลี่ยการให้คำปรึกษาและฝึกอบรม อาจใช้เวลา 6 -10 เดือน
Q : งบประมาณในการจัดทำ
A : งบประมาณอาจจะแบ่งเป็น 3 ส่วน คือ การให้คำปรึกษาและฝึกอบรม งบประมาณสำหรับการพัฒนาผลิตภัณฑ์ และกระบวนการผลิต ที่จำเป็น และงบประมาณส่วนสุดท้าย คือการยื่นขอการรับรอง ต้องใช้งบประมาณเท่าไหร่ ที่ปรึกษาประเมินปัจจัยไว้เช่นเดียวกับคำตอบในข้อข้างต้น คือ ขึ้นอยู่กับเงื่อนไขของเครื่องมือแพทย์ ระดับความเสี่ยง กฎหมายจากหน่วยงานกำกับดูแล (Regulator) มาตรฐานการส่งออก และรวมถึงนโยบายของฝ่ายบริหาร ในการมุ่งมั่น ในการลดความเสี่ยงและเพิ่มประสิทธิภาพอย่างไร ดังนั้นงบประมาณ จึงเป็นเรื่องที่ประเมินได้ยาก แต่หากผู้ประกอบการต้องการทราบ หรือจัดเตรียมงบประมาณในการจัดทำระบบ แนะนำให้ติดต่อ ฝ่ายขายของ Q Time consulting หรือ ที่ @qtimeconsult ได้เพื่อประเมินและทำแผนงานเสนอ
ข้อมูลสำคัญและเพิ่มเติมการพิจารณา เพราะกฎหมาย มาตรฐานเครื่องมือแพทย์มีประกาศใหม่เสนอทั้งนี้ เพื่อความปลอดภัยของผู้บริโภคหรือผู้ป่วย ในการให้คำปรึกษาของที่ปรึกษา Q Time consulting จึงให้ความสำคัญกับข้อกำหนดกฎหมายด้วย ในการขอการรับรอง ISO13485 ทีมที่ปรึกษา การันตี ผ่านการรับรอง 100%
ISO 13485 ข้อกำหนด ฉบับสรุปย่อ 5 ข้อกำหนด
การเปรียบเทียบข้อกำหนด GMP Medical Device และ ISO13485
ติดต่อสอบถามเพิ่มเติม กับทีมที่ปรึกษา @qtimeconsult หรือ This email address is being protected from spambots. You need JavaScript enabled to view it.

