
Usability Engineering for Medical Devices
IEC60601-1-6 / IEC62366-1
“การใช้งานเครื่องมือแพทย์ให้ง่าย สะดวก เพิ่มประสิทธิภาพการใช้และลดความเสี่ยง”
Usability Engineering ปัจจุบันเป็นหนึ่งในข้อบังคับที่สำคัญสำหรับผู้ออกแบบพัฒนาและผลิตเครื่องมือแพทย์
และส่วนหนึ่งของข้อกำหนด ISO13485 ในข้อกำหนดที่ 7.3 กระบวนการตรวจสอบและตรวจรับรองความถูกต้องของการออกแบบ (Design Verification and Validation )ผลจากการออกแบบและพัฒนาเครื่องมือแพทย์ นอกจากการรักษา วินิจฉัย ได้ตามวัตถุประสงค์แล้ว ยังต้องออกแบบให้ผลิตภัณฑ์ใช้งานสะดวก รวดเร็วไม่ซับซ้อน ลดความผิดพลาดระหว่างการใช้ เพิ่มความปลอดภัย ทันต่อเหตุการณ์ ทันต่อการรักษา ปัจจัยที่พิจารณาคือ ปัจจัยมนุษย์และการยศาสตร์ (Ergonomics) หลักของปัจจัยวิศวกรรมมนุษย์ (Human Factor Engineering) โดยเน้นการศึกษาความสัมพันธ์ หรือปฏิสัมพันธ์ระหว่างผู้ใช้ และอุปกรณ์หรือผลิตภัณฑ์เครื่องมือแพทย์
ทำไมต้อง Usability Engineering
การศึกษาหรือทดสอบด้าน Usability Engineering โดยเน้นถึงความปลอดภัยและสุขภาพอนามัยของผู้ใช้และผู้ป่วยเป็นสำคัญ สำหรับเครื่องมือแพทย์ในปัจจุบันมีการออกแบบด้วยเทคโนโลยีที่ทันสมัย ให้ใช้งานได้ง่ายขึ้น เช่น มีเมนูคำสั่ง มีรูปแบบระบบซอฟท์แวร์ปฏิบัติการที่ทันสมัย มีระบบทัชสกรีน (Touch screen) โดย ระบบเซ็นเซอร์ที่ลดการสัมผัส จึงจำเป็นต้องมีการทดสอบ พิสูจน์ว่าผู้ใช้สามารถใช้ได้ง่าย หากผู้ใช้มีความผิดพลาด หรือ use error ผลิตภัณฑ์มีส่วนช่วยป้องกันอันตรายจากความผิดพลาดนั้นได้อย่างไร ตัวอย่างเช่น ผู้ป่วยโรคไต ต้องการฟอกเลือดด้วยตัวเองที่บ้าน (Home Hemodialysis) จะต้องรู้และเข้าใจวิธีการติดตั้ง ต่อเชื่อมหลอดเลือดหรือสายสำหรับฟอกเลือด ระบบน้ำ เครื่องไตเทียม ตัวกรองเลือด และสายส่งเลือด ซึ่งมีขั้นตอนการติดตั้งก่อนการใช้งานหลายขั้นตอน ผู้ผลิตจึงต้องออกแบบอุปกรณ์ ชิ้นส่วนต่างๆ ให้ง่าย เพื่อให้ผู้ป่วยไม่สับสน สะดวก ลดการผิดพลาดได้ ดังนั้น Usability Engineering จึงให้ความสำคัญปัจจัยในการใช้งานได้ง่าย สะดวก ลดความเสี่ยง
ตัวอย่างปัจจัยที่ส่งเสริมให้การใช้งานได้ง่ายและลดความเสี่ยง
- User Interface การใช้งานของผู้ใช้ เพราะหากผู้ใช้ไม่ได้มีคุณสมบัติตามวัตถุประสงค์การใช้งานเครื่องมือแพทย์ ผู้ใช้อาจมีโอกาสใช้ผิดพลาดได้
- Information provided /Accompany Document ข้อมูล การสื่อสาร จากผู้ผลิตหรือเจ้าของผลิตภัณฑ์ไปสู่ผู้ใช้ (User) เช่นการจัดเตรียม คู่มือการใช้งาน (User Manual) การแสดงฉลากบ่งชี้หรือแนะนำการใช้งาน (Labelling)
- Training of users การฝึกอบรมการใช้งานเครื่องมือแพทย์ให้ถูกวิธี
การทดสอบด้านการใช้งานเครื่องมือแพทย์ Usability Engineering test จึงมีวัตถุประสงค์เพื่อลดความเสี่ยง เพิ่มประสิทธิภาพการใช้งาน สร้างประสบการณ์ที่ดีให้กับผู้ใช้แลผู้ป่วย (User & End User ) และสอดคล้องกับกฎระเบียบข้อบังคับจากหน่วยงานกำกับดูแลของทุกประเทศ
Human Factor Engineering -HFE
อุปกรณ์เครื่องมือแพทย์ที่ถูกออกแบบ มีเป้าหมายคือใช้ได้อย่างมีประสิทธิภาพการรักษาและมีความปลอดภัยมากที่สุด การใช้งานจึงถูกใช้ภายใต้ข้อจำกัดของมนุษย์ โดยพิจารณาในเรื่อง การสัมผัส การได้ยิน การได้กลิ่น การเห็น ความจำ จิตสำนึก ประสบการณ์
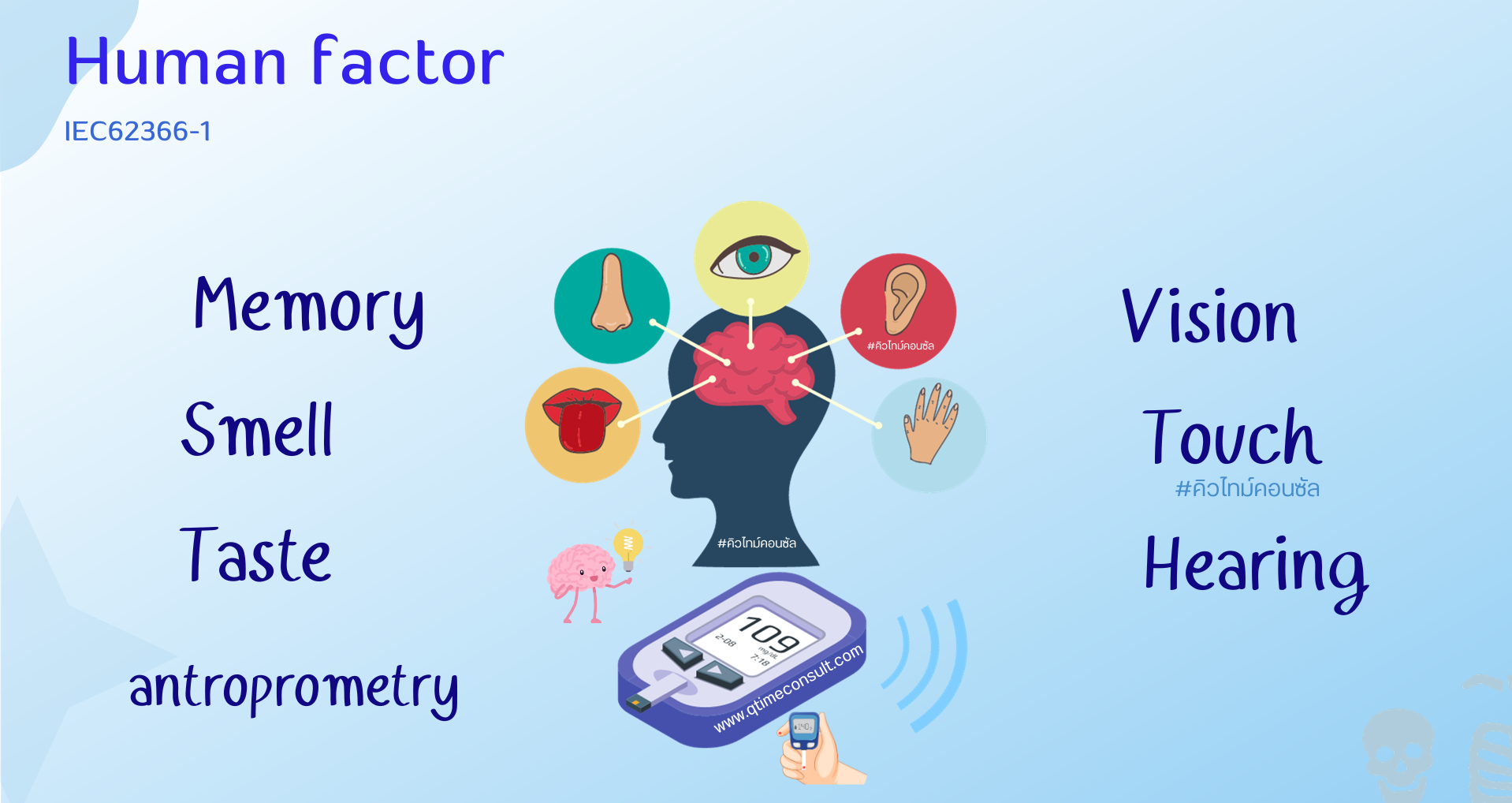
แนวทางการศึกษาและทดสอบ Usability
ผู้ออกแบบและผลิตเครื่องมือแพทย์ (Desing and Manufacturer) ต้องจัดเตรียมข้อมูล เอกสาร ที่จะสื่อสารให้ผู้ใช้ได้เข้าใจ ถึงวิธีใช้ก่อนเริ่มใช้งานเครื่องมือแพทย์ เช่น คู่มือการใช้งาน VDO อธิบายการใช้งาน ฉลาก (Label) และพิจารณาความเหมาะสมถึงวิธีการที่ต้องการทดสอบการใช้งานผลิตภัณฑ์
ตัวอย่างการทดสอบและศึกษาการใช้งานเครื่องมือแพทย์
- Questionnaire การใช้แบบสอบถามสำรวจการใช้งานเครื่อง
- ความคิดเห็นของผู้ใช้ในระหว่างกระบวนการออกแบบ
- การทดลองการใช้งานกับผู้ใช้หรือผู้ป่วย
- การสังเกตการณ์ใช้งานเครื่อง และความผิดพลาดที่อาจจะเกิดขึ้นในแต่ละขั้นตอน
- การประเมินโดยผู้เชี่ยวชาญ

Risk Management การประเมินความเสี่ยง
ในขั้นตอนการออกแบบและพัฒนาผลิตภัณฑ์ RD จะต้องบ่งชี้และการวิเคราะห์ความเสี่ยงเบื้องต้นในขั้นตอนการใช้งานของผู้ใช้ (User) จะมีข้อผิดพลาดใด และจะส่งผลกระทบหรืออันตรายอย่างไรต่อผู้ใช้และผู้ป่วย ในแต่ละขั้นตอนการใช้งานผลิตภัณฑ์ (use scenario) ด้วย และหลังจากได้ผลิตภัณฑ์แล้วมีการทดสอบการใช้งานแล้ว ต้องวิเคราะห์และสรุปความเสี่ยง หากยังคงเป็นความเสี่ยงรุนแรงหรือมีโอกาสเกิดความผิดพลาดได้บ่อย ผู้ออกแบบและพัฒนา หรือฝ่าย RD ต้องพิจารณาหาแนวทางลดความเสี่ยงนั้นก่อนปล่อยผลิตภัณฑ์สู่ตลาด

แนวทางการประเมินความเสี่ยง ยังคงใช้ ISO14971:2019 เป็นแนวทาง คือ ระบุ Hazard – Risk Analysis – Risk Evaluation -Risk Control and Residual risk การจัดทำแผนและรายงานบริหารความเสี่ยง
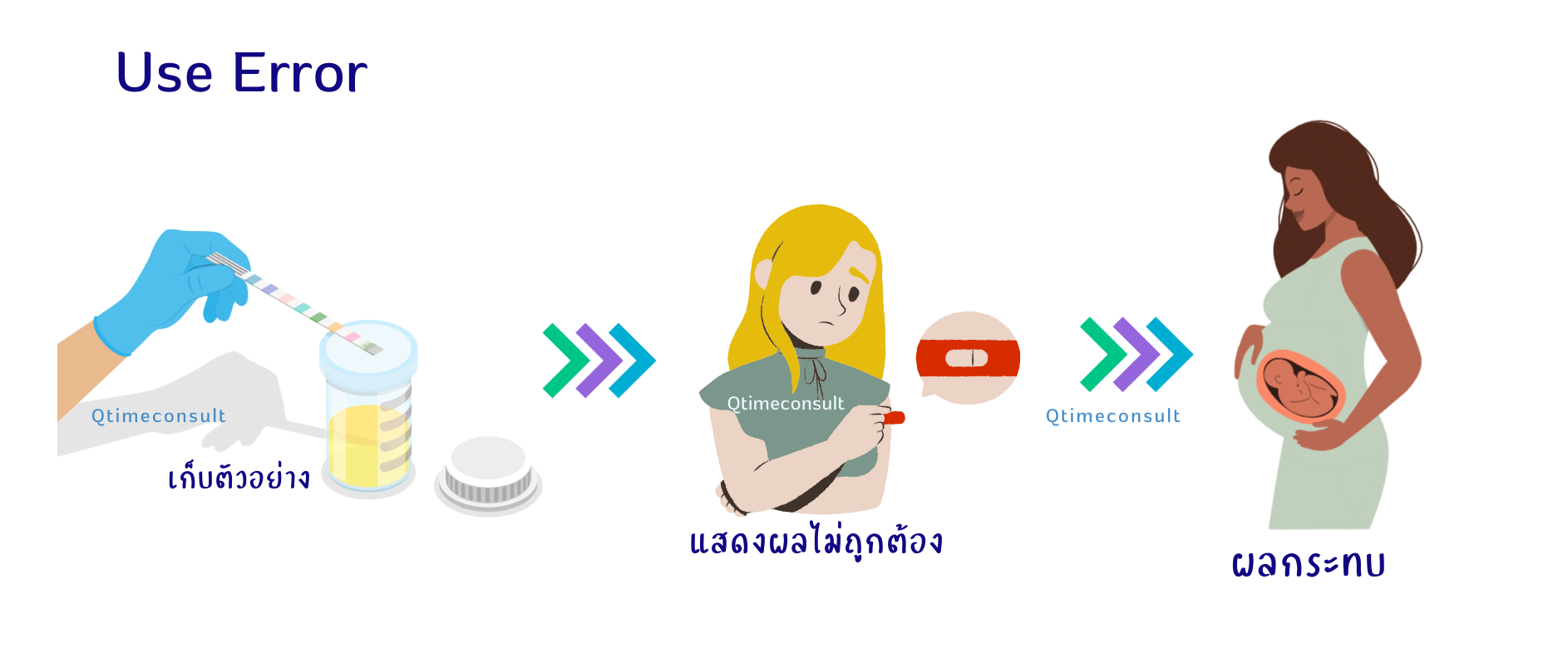
ตัวอย่าง ลักษณะข้อผิดพลาดของการใช้ (Use Error)
- Attentional failure ผู้ใช้ตั้งใจใช้ผิด เช่นการนำมาใช้ซ้ำ
- Memory failure ความทรงจำ เช่น กดปุ่มคำสั่งไม่ถูกต้อง
- Rule-based failure การใช้ผิดจากที่กำหนด
- Knowledge-based failure ความรู้ความชำนาญไม่เพียงพอ
- Routine violation ใช้ผิดเป็นประจำ เกิดจากความเคยชิน เป็นเรื่องปรกติ หรือมีผู้ใช้คนอื่นใช้แบบนี้เป็นประจำ
**Use Error ความผิดพลาดที่อาจจะเกิดจากสถานการณ์ หรือเหตุการณ์ใด ที่เป็นปัจจัยทำให้เกิดข้อผิดพลาดของผู้ใช้ เน้นข้อผิดพลาดที่มาจากสาเหตุอื่นๆ เช่น การออกแบบเชิงวิศวกรรม เทคโนโลยี ความถี่ของการใช้งาน สภาพแวดล้อม
ตัวอย่าง Use Error : ผู้ใช้สวมใส่คอนแทคเลนส์ เมื่อสวมใส่แล้วเกิดความไม่สะดวกสบาย ไม่สามารถมองเห็นได้ตามคาดหวัง เมื่อวิเคราะห์สาเหตุมาจากผู้ใช้ไม่ทราบว่าต้องใส่ด้านใด อาจจะวิเคราะห์ได้ว่า ผลิตภัณฑ์ไม่ได้ออกแบบให้มีความแตกต่าง ในด้านที่ควรต้องสวมใส่เพื่อการมองเห็นและเหมาะสมกับรูปทรงของตา
Usability standards for medical devices
การศึกษาการใช้เครื่องมือแพทย์ ตามข้อกำหนด IEC60601-1-6 เป็นข้อกำหนดพื้นฐานและประสิทธิภาพ (Essential performance) สำหรับผลิตภัณฑ์อุปกรณ์ไฟฟ้าทางการแพทย์ ต้องระบุกระบวนการสำหรับผู้ผลิตในการวิเคราะห์ และตรวจสอบความถูกต้องของการออกแบบ ในการใช้งาน เนื่องจากเกี่ยวข้องกับความปลอดภัยและประสิทธิภาพ และสำหรับ IEC 62366-1 Guidelines แนวทางการการทดสอบศึกษาการใช้งาน โดยให้ความสำคัญ Error in use หรือ use error ในสภาวะการใช้งานปรกติ (Normal conditions)
ขั้นตอนการจัดทำ Usability Engineering File
- ศึกษาอบรมข้อกำหนดแนวทาง IEC 60601-1-6, IEC62366
- กำหนดขอบเขตเครื่องมือแพทย์
- สรุปการออกแบบ และการใช้ผลิตภัณฑ์เครื่องมือแพทย์
- ระบุและวิเคราะห์ความเสี่ยง
- กำหนดวิธีการทดสอบ เช่นทดสอบโดยห้องปฏิบัติการ (Laboratory)
- ดำเนินการทดสอบ (Usabiltity Engineering Test)
- สรุปผล กำหนดวิธีการประเมินและควบคุมความเสี่ยง (Risk Management)
- จัดทำ UEF -Usability Engineering File
แหล่งที่มาของข้อมูล
IEC 60601-1-6 : Medical electrical equipment - Part 1-6: General requirements for basic safety and essential performance - Collateral standard: Usability
IEC 62366-1:2015 Medical Devices Part 1:Application of usability engineering to medical devices
IEC 62366-2:2016 Medical Devices Part 2: Guidance on the application of usability engineering to medical devices

